
科技改變生活 · 科技引領未來

科技改變生活 · 科技引領未來
在《銀屑病:減肥和飲食調整改善病情》我們介紹了如何通過減肥和調整飲食改善銀屑病,這一篇繼續介紹生物制劑和幾種營養素的作用。回顧上一篇,我們簡單介紹了樹突細胞,免疫T細胞,巨噬細胞、皮膚的角質細胞等,共同參與炎癥的級聯反應(cascade),
在《銀屑病:減肥和飲食調整改善病情》我們介紹了如何通過減肥和調整飲食改善銀屑病,這一篇繼續介紹生物制劑和幾種營養素的作用。
回顧上一篇,我們簡單介紹了樹突細胞,免疫T細胞,巨噬細胞、皮膚的角質細胞等,共同參與炎癥的級聯反應(cascade),導致細胞因子包括IL-17A、IL-23、IL-22、TNF-α等的大量分泌,這些細胞因子都參與到銀屑病的病例機制。 那究竟為什么這些免疫細胞會“無緣無故”被喚起? 其中一個理論,跟所有免疫系統有關疾病和炎癥一樣,銀屑病很可能跟身體的氧化應激有關。
下圖簡化包括代謝性疾病、MAP激酶信號等導致的氧化應激跟銀屑病的關系。MAP激酶細胞信號可以啟動銀屑病的炎癥級聯反應,而身體的氧化應激也是MAP激酶被喚起的誘因,當身體的氧化應激嚴重,自由基ROS/RNS導致皮膚炎癥,產生大量的致炎癥細胞因子,直接導致角質細胞的增殖和炎癥的持續。[46]
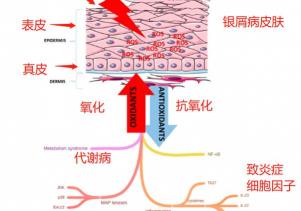
臨床上多年來都有采用外用藥物,包括糖皮質醇和維生素D衍生物等治療銀屑病,而最新銀屑病的治療手段是通過生物制劑,包括上一代的TNF-α抑制劑(etanercept, infliximab, 和adalimumab)和新一代的IL-17A、IL-23、IL-22抑制劑等。
生物制劑治療銀屑病
近年應用生物制劑治療銀屑病有不錯的突破,由于銀屑病是免疫細胞跟皮膚角質細胞在不同的致炎癥細胞因子影響下的炎癥反應,生物制劑主要有幾個治療方向:1)抑制TNF-α, 2)抑制IL-17,和3)抑制IL-23。[1]
2020年發表的雙盲對照組臨床研究,[2] 使用過TNF-α抑制劑無效的銀屑病患者,在使用IL-17A抑制劑,蘇金單抗(300mg)72周后,77%患者的達到PASI 75的局部康復標準,證明該藥比上一代的靶點在TNF-α生物制劑更為有效。 2020年挪威發表的研究論文,詳細比較了IL-17,IL-23,和TNF抑制劑的生物制劑,結論也是IL-17和IL-23為靶點的生物制劑比TNF-α有效。[1]
2015年被美國FDA和2019年被中國藥監局批準作為銀屑病治療的生物制劑蘇金單抗(Secukinumab,商品名“可善挺”)為例,我們從2個大型的雙盲對照組臨床研究可以看到其效果。[3] 蘇金單抗是IL-17A致炎癥細胞因子的抑制劑。ERASURE臨床試驗的受試者樣本是738名,而FIXTURE臨床試驗的樣本是1306名銀屑病患者,連續5周每周注射一次(150mg或300mg),之后4周一次持續約一年,結果顯示PASI 75,也就是銀屑病改善75%的患者,在第12周ERASURE臨床研究的受試者有81.6%(300mg)和71.6%(150mg),而FIXTURE臨床研究的受試者有77.1%(300mg)和67.0%(150mg),都顯示治療銀屑病的效果顯著。
該藥在2019年也發表了對中國銀屑病中度到重度患者的雙盲對照組臨床研究的結果,[4] 441名中國的銀屑病患者參與試驗,在接受蘇金單抗治療12周后97.7%(300mg)和82.3%(150mg)的患者改善銀屑病75%(PASI 75指數),效果持續到治療結束的52周后。
日本在2019年發表的雙盲對照組臨床研究,[5]跟蹤了接受蘇金單抗治療(300mg)康復的銀屑病患者3年,發現在3年內復發的比例不算高,PASI 90 (改善90%)和PASI 100 (100%改善)的患者在3年后分別為69.2%和53.8%。
除了蘇金單抗之外,同樣以IL-17A為靶點的生物制劑還有ixekizumab和Brodalumab,效果都不錯。[6]
也有生物制劑的靶點是IL-23致炎癥細胞因子,IL-23介導Th17細胞分泌IL-17致炎癥細胞因子,所以抑制IL-23同樣可以阻斷銀屑病的炎癥級聯反應。針對IL-23的生物制劑是risankizumab(商品名Skyrizi),在2019年被美國FDA批準作為治療銀屑病用藥,雙盲對照組臨床研究發現,Skyrizi使72%-75%的銀屑病患者達到PASI 90的局部康復,用藥1年后56%-60%達到PASI 100,也就算是完全康復。 跟蘇金單抗比較,Skyrizi只需要開始在4周內注射2次,之后3個月一次就可以了,頻次更低,對患者造成的不便可以減少。[7]
生物制劑對銀屑病患者帶來希望,但價格較貴。 有研究統計過美國銀屑病患者使用不同生物制劑達到基本效果(PASI 75<)的成本,[8] 因為不是一個療程就一定可以達標,之后可能還得補幾針,而且不同生物制劑要出效果的劑量和注射次數不一樣,最低消費在6.2萬美元以上,只能局部改善(PASI 75),如果要達到PASI 100,最低消費是23萬美元。我國的生物制劑價格較低,蘇金單抗大概3000元一針,一年15到30針就4.5萬到9萬人民幣,之前評論區有反映此藥進醫保后價格降到1200一針。(數字只作為大概的參考,具體到醫院咨詢)
生物制劑的價格只是其中一個局限,由于IL-17A是人體對抗念珠菌的免疫反應的重要細胞因子,抑制IL-17的生物制劑的其中一個副作用是增加真菌念珠菌的感染風險,所以對于有IBD炎癥性腸病的患者是不適應使用的。[6] 2020年發表的一項對使用IL-17A抑制劑的強直性脊柱炎患者和銀屑病患者的研究發現,使用IL-17A生物制劑容易導致腸道炎癥,1L-17A抑制劑改變腸道菌群,增加腸道中的念珠菌。[9] 其實銀屑癥患者跟炎癥性腸病(IBD)的關聯性很高,分析銀屑癥患者和IBD患者的菌群也發現有不少共通性。 [10] 對照組隊列研究發現銀屑病患者的腸道菌群失衡,菌群的多樣性減少,個別菌種相對健康對照組顯著較高。[11]
把這些連起來,我個人的猜想是:腸道的真菌過度生長,可能促使免疫系統增加分泌IL-17家族細胞因子作為對真菌感染的免疫反應,但IL-17同時導致皮膚的炎癥反應,結果可能是銀屑病的病癥,所以抑制IL-17可以緩解銀屑病病情,但也等于需要對念珠菌感染“投降”,如果真的是這樣的話,處理腸道問題特別是腸道真菌過度生長,可能是治療銀屑病的其中一個治本路徑。但上述純屬我的個人猜測,有待日后臨床研究進一步的發現。
TNF-α、IL-17和IL-23都只是銀屑病炎癥中的信使(messengers),治療銀屑病的生物制劑雖然阻斷了銀屑病的炎癥級聯反應,但可能只是“殺死信使”(kill the messenger)的解決辦法而已,因為并沒有真正治療引起銀屑病的身體氧化應激問題,不排除銀屑病還會復發,也不排除氧化應激的結果出現在銀屑病之外的健康問題上,包括其他免疫系統有關的疾病。2012年一項大型隊列研究,[12] 包括了2萬5千多名銀屑病患者樣本,發現銀屑病患者患上另外2種或以上的自免疫系統疾病的風險更高,風險增加90%。而同時患上乳糜瀉的風險是正常人的2.2倍。
無論是否使用生物制劑,都需要從飲食等更根本的方法入手解決身體氧化應激問題。
魚油
1988年在《柳葉刀》發表的一項雙盲對照組臨床研究,[13] 28名銀屑病患者接受試驗,干預組每天3g的歐米茄魚油,對照組使用橄欖油,8周后有干預組的銀屑病病情顯著改善,包括痕癢較少,銀屑病的皮膚面積減少等。
1990年的一項臨床研究,[14]80名已經病情穩定的銀屑病患者接受試驗,當中34名同時患銀屑病性關節炎(psoriatic arthritis),受試者連續8周每天補充1.1g的EPA+0.75g的DHA,結果在4周后反映銀屑病病情的PASI指數從平均3.56降低到1.98,然后在試驗8周后減低到1.24,7名患者完全康復,13名患者改善75%,大部分銀屑病性關節炎患者表示關節疼痛減少。
1998年的一項雙盲對照組臨床研究,[15]83名銀屑病患者接受試驗,干預組連續14天每天通過輸液補充4.2g的EPA+DHA,結果PASI指數減少11.2,一共16名干預組受試者(37%)的病情改善超過50%。
另一項類似的雙盲對照組臨床試驗,[16] 20名銀屑病患者連續10天每天通過輸液補充4.2g的EPA+DHA,免疫細胞的中性粒細胞PAF因子在歐米茄3補充后顯著減少,銀屑病病情快速得到緩解。
一項15周的雙盲對照組研究,[17] 魚油配合紫外光燈治療銀屑病病,比對照組的橄欖油配合紫外光燈治療效果更顯著,研究認為考慮到魚油的安全性,是最佳輔助治療銀屑病的手段。另一項對照組臨床研究,[18] 干預組使用外用維生素D軟膏(tacalcitol)加上歐米茄3魚油,對照組只使用維生素D軟膏,8周后2組受試者的銀屑病病情都顯著改善,但添加了魚油的干預組改善更為顯著。臨床研究也顯著使用EPA配合處方藥(etretinate)比單獨使用處方藥對改善銀屑病病情更有效。[19]
2019年的一項薈萃分析,[20] 包括了10個臨床試驗一共560名患者樣本,發現歐米茄3可以顯著降低PASI,降低平均1.58,也顯著減少紅疹和痕癢,劑量高的歐米茄3效果更為明顯。2020年的一項系統性回顧,[21] 包括了18個臨床研究一共927名患者樣本,發現歐米茄3魚油作為輔助治療可以顯著降低PASI指數平均3.92,但單獨使用魚油治療效果并不明顯。歐米茄3魚油對改善銀屑病病情的臨床研究也有不少顯示作用不顯著。[22] 歐米茄3中,EPA對銀屑病的作用明顯,因為EPA有較強的緩解炎癥的作用。[23]
不少臨床研究證實歐米茄3魚油可以改善銀屑病病情,但也有臨床研究發現效果不顯著,學者認為可能跟EPA比例和整體魚油食用劑量低有關系。[24] 魚油是極為安全的營養素,可以改善多種身體的炎癥有關疾病,就算研究證據沒有達到一致,都值得嘗試。
維生素D
活性維生素D(1,25(OH)2D)是免疫系統重要的調節介質,可以減少致炎癥細胞因子包括TNF-a、IL-1、IL-6等。 樹突細胞是銀屑病發病機制的重要細胞,維生素D壓制樹突細胞的分化、成熟和減少抗原呈遞。 維生素D也壓抑免疫T細胞的增殖,減少致炎癥細胞因子IL-17A,IL-22的產生。
關聯性研究發現缺乏維生素D跟銀屑病有較強的關聯性,補充維生素D可能對緩解銀屑病有幫助。[25] 2018年的對照組研究,[26] 分析了561名銀屑病患者和340名對照組健康受試者,發現銀屑病患者的維生素D水平(21.8ng/ml)比對照組(34.3ng/ml)顯著較低,而且病齡長的患者的維生素D水平也更低。
1986年已經有開放標簽臨床研究發現維生素D可以改善銀屑病。 [27] 連續6個月補充維生素D3的銀屑病患者,76%顯著改善病情。
1988年的臨床研究,[28] 發現口服維生素D和外用維生素D軟膏對改善銀屑病都有幫助。 17名銀屑病受試者,14名口服維生素D的受試者,當中10名顯著改善,3名使用外用維生素D的受試者同樣顯著改善,而且6周后就見效果。
科英布拉療法(Coimbra Protocol)是使用大劑量維生素D的治療方法。2013年先導性臨床試驗,[29]對銀屑病(9名)患者連續6個月每天使用35000IU的維生素D,治療后銀屑病受試者的維生素D水平從起始的平均14.9ng/ml提升到106.3ng/ml,結果全部9名銀屑病受試者病情顯著改善,檢查受試者期間的肝功能,腎功能和血鈣沒有出現異常,尿液排出鈣期間則在正常范圍內有所增加。科英布拉療法較受爭議性,但該研究的確發現維生素D可以成功改善銀屑病。
2019年泰國發病的一項雙盲對照組臨床研究,[30] 45名輕度銀屑病患者(PASI<10)接受試驗,干預組每2周口服一次60000IU的維生素D2,對照組只有安慰劑。受試者有26.7%缺乏維生素D(<20ng/ml),高于泰國缺乏維生素D的平均人群(5.7%接近)5倍。3個月后補充維生素D的干預組的PASI指數改善優于對照組,血清維生素D水平也提升了,而且血清維生素D水平跟PASI指數有反向關系。
紫外線治療銀屑病有一定效果,當中提升維生素D水平可能是其中的重要機制。臨床研究使用紫外線治療銀屑病,同時發現銀屑病患者在病情改善的同時血清維生素D水平也上升。[31] 但也有臨床研究發現口服維生素D對改善銀屑病沒有顯著幫助。[32] [33]
外用維生素衍生物(vitamin D analogues)藥膏對緩解銀屑病有一定效果。2017年的系統性回顧,比較了糖皮質醇和維生素D兩種外用藥,結論是兩者的效果相當。[34] 但2012年的一項系統性分析,[35] 包括了51個臨床試驗,發現單獨的維生素D外用藥,治療成功率只有4%-40%,但混合維生素D和糖皮質醇的外用藥,治療成功率可以高一倍,達到27%-53%。 但維生素D外用藥比激素類藥物更為安全,更適合作為長期使用。[36]
抗氧化物
文獻回顧發現不同的抗氧化物的組合對緩解銀屑病可能有幫助。[37] 但臨床研究并沒有發現哪一種抗氧化物對改善銀屑病顯著有效。
2009年的對照組臨床研究,[38] 銀屑病患者補充輔酶Q10(50mg泛醇)、維生素E(50mg)和硒可以改善患者的氧化應激,干預組的銀屑病病情有輕微改善。
早年有先導性臨床研究發現B12可以改善銀屑病,[39] 通過注射B12的34名銀屑病患者,11名康復,10名達到PASI 75局部康復。但另一項對照組臨床研究,卻發現B12沒有幫助。[40] 類似的情況在硒中出現,沒有確切臨床證據證明硒可以改善銀屑病。
2015年的臨床研究,[41] 63名輕度銀屑病患者(PASI<10),干預組每天口服2g的姜黃素加外用糖皮質醇藥膏,對照組只使用藥膏,12周后姜黃素干預組顯著改善,而且血清IL-22致炎癥細胞因子顯著下降。研究的結論是姜黃素可以作為輔助治療銀屑病。
2018年的對照組臨床研究,[42]40名中度到重度頭皮銀屑病患者接受試驗,干預組每天兩次使用姜黃(turmeric tonic),9周試驗過后干預組顯著改善頭皮銀屑病病癥。
2015一項臨床試驗,使用口服姜黃素作為輔助治療,同樣發現銀屑病患者有顯著的改善。[43]
2019年的文獻回顧,[44] 分析了姜黃素對治療不同皮膚有關疾病的文獻,結論是姜黃素效果不錯,便宜、安全和有效(low-cost, well-tolerated, effective),但需要克服生物利用率較低的難題。2019年的另一項對姜黃素和皮膚病的文獻回顧的結論也是一致的。[45]
總結
減肥和飲食調整對改善銀屑病有不錯的效果,除此之外,我們從近年的研究也可以得出下面的結論:
1 生物制劑可以有效緩解銀屑病,特別是針對IL-17和IL-23作為靶點的第二代生物制劑;
2 多種生物制劑證明是安全和副作用較少的治療手段,有條件的銀屑病患者可以選擇使用;
3 但生物制劑除了治療成本較高外,也容易造成真菌感染和因為小腸真菌過度生長導致的腸道炎癥。
4 生物制劑從“中間介入”阻斷炎癥的級聯反應,但沒有解決氧化應激的源頭問題,不太確定究竟生物制劑的效果可以維持多久,也不確定消除銀屑病病癥但不處理導致銀屑病的氧化應激是否會出現其他的炎癥有關疾病;
5 魚油治療銀屑病的研究證據雖然并不一致,但魚油的安全性和改善身體整體健康的特性,值得使用作為緩解銀屑病的營養素;
6 維生素D在治療銀屑病的研究證據同樣不一致,但經檢查發現缺乏維生素D的,補充足夠的維生素D,對改善健康都是有益的。缺乏維生素D的銀屑病患者,值得嘗試補充維生素D;
7 臨床研究沒有發現什么抗氧化物對改善銀屑病有很明顯的效果,當中姜黃素有一定的證據支持,但由于較低的生物利用率,限制了它的有效應用。
免責聲明:
本文內容僅作為科普知識提供,不能代替醫生的治療診斷和建議。文章內容中涉及醫學的部分均來源于參考文獻。
參考
[1] Ten Bergen, L. L., Petrovic, A., Krogh Aarebrot, A., & Appel, S. (2020). The TNF/IL-23/IL-17 axis-Head-to-head trials comparing different biologics in psoriasis treatment. Scandinavian journal of immunology, 92(4), e12946. https://doi.org/10.1111/sji.1294
[2] Warren, R. B., Barker, J., Finlay, A. Y., Burden, A. D., Kirby, B., Armendariz, Y., Williams, R., Hatchard, C., Khare, S., & Griffiths, C. (2020). Secukinumab for patients failing previous tumour necrosis factor-α inhibitor therapy: results of a randomized open-label study (SIGNATURE). The British journal of dermatology, 183(1), 60–70. https://doi.org/10.1111/bjd.18623
[3] Langley, R. G., Elewski, B. E., Lebwohl, M., Reich, K., Griffiths, C. E., Papp, K., Puig, L., Nakagawa, H., Spelman, L., Sigurgeirsson, B., Rivas, E., Tsai, T. F., Wasel, N., Tyring, S., Salko, T., Hampele, I., Notter, M., Karpov, A., Helou, S., Papavassilis, C., … FIXTURE Study Group (2014). Secukinumab in plaque psoriasis--results of two phase 3 trials. The New England journal of medicine, 371(4), 326–338. https://doi.org/10.1056/NEJMoa1314258
[4] Cai, L., Zhang, J. Z., Yao, X., Gu, J., Liu, Q. Z., Zheng, M., Zhang, S. F., Xu, J. H., Li, C. X., Cheng, H., Guo, Q., Pan, W. L., Li, S. Q., Li, R. Y., Guo, Z. P., Song, Z. Q., Li, S. S., Dong, X. Q., Wang, L., Fu, R., … Patekar, M. (2020). Secukinumab demonstrates high efficacy and a favorable safety profile over 52 weeks in Chinese patients with moderate to severe plaque psoriasis. Chinese medical journal, 133(22), 2665–2673. https://doi.org/10.1097/CM9.0000000000001163
[5] Okubo, Y., Ohtsuki, M., Morita, A., Yamaguchi, M., Shima, T., Tani, Y., Nakagawa, H., & Extension Study Japanese Subgroup (2019). Long-term efficacy and safety of secukinumab in Japanese patients with moderate to severe plaque psoriasis: 3-year results of a double-blind extension study. The Journal of dermatology, 46(3), 186–192. https://doi.org/10.1111/1346-8138.14761
[6] Craig, S., & Warren, R. B. (2020). Ixekizumab for the treatment of psoriasis: up-to-date. Expert opinion on biological therapy, 20(6), 549–557. https://doi.org/10.1080/14712598.2020.1729736
[7] Li, W., Ghamrawi, R., Haidari, W., & Feldman, S. R. (2020). Risankizumab for the Treatment of Moderate to Severe Plaque Psoriasis. The Annals of pharmacotherapy, 54(4), 380–387. https://doi.org/10.1177/1060028019885836
[8] Blauvelt, A., Burge, R., Malatestinic, W., Brnabic, A., Guo, J., Janardhanan, M., & Zhu, B. (2021). Cost per cumulative clinical benefit of biologic therapies for patients with plaque psoriasis: a systematic review. Journal of managed care & specialty pharmacy, 27(1), 84–94. https://doi.org/10.18553/jmcp.2021.27.1.084
[9] Manasson, J., Wallach, D. S., Guggino, G., Stapylton, M., Badri, M. H., Solomon, G., Reddy, S. M., Coras, R., Aksenov, A. A., Jones, D. R., Girija, P. V., Neimann, A. L., Heguy, A., Segal, L. N., Dorrestein, P. C., Bonneau, R., Guma, M., Ciccia, F., Ubeda, C., Clemente, J. C., … Scher, J. U. (2020). Interleukin-17 Inhibition in Spondyloarthritis Is Associated With Subclinical Gut Microbiome Perturbations and a Distinctive Interleukin-25-Driven Intestinal Inflammation. Arthritis & rheumatology (Hoboken, N.J.), 72(4), 645–657. https://doi.org/10.1002/art.41169
[10] Visser, M., Kell, D. B., & Pretorius, E. (2019). Bacterial Dysbiosis and Translocation in Psoriasis Vulgaris. Frontiers in cellular and infection microbiology, 9, 7. https://doi.org/10.3389/fcimb.2019.00007
[11] Hidalgo-Cantabrana, C., Gómez, J., Delgado, S., Requena-López, S., Queiro-Silva, R., Margolles, A., Coto, E., Sánchez, B., & Coto-Segura, P. (2019). Gut microbiota dysbiosis in a cohort of patients with psoriasis. The British journal of dermatology, 181(6), 1287–1295. https://doi.org/10.1111/bjd.17931
[12] Wu, J. J., Nguyen, T. U., Poon, K. Y., & Herrinton, L. J. (2012). The association of psoriasis with autoimmune diseases. Journal of the American Academy of Dermatology, 67(5), 924–930. https://doi.org/10.1016/j.jaad.2012.04.039
[13] Bittiner, S & Tucker, W.F.G. & Cartwright, I & Bleehen, S. (1988). A double-blind, randomised, placebo-controlled trial of fish oil In psoriasis. Lancet. 1. 378-80. 10.1016/S0140-6736(88)91181-6.
[14] Lassus, A & Dahlgren, Atti-La & Halpern, M.J. & Santalahti, J & Happonen, H. (1990). Effects of Dietary Supplementation with Polyunsaturated Ethyl Ester Lipids (Angiosan?) in Patients with Psoriasis and Psoriatic Arthritis. The Journal of international medical research. 18. 68-73. 10.1177/030006059001800109.
[15] Mayser, Peter & Mrowietz, Ulrich & Arenberger, Peter & Bartak, Pavel & Buchvald, Jozef & Christophers, Enno & Jablonska, Stefania & Salmhofer, Werner & Schill, Wolf-Bernhard & Kr?mer, Hans-Joachim & Schlotzer, Ewald & Mayer, Konstantin & Seeger, Werner & Grimminger, Friedrich. (1998). ω-3 Fatty acid-based lipid infusion in patients with chronic plaque psoriasis: Results of a double-blind, randomized, placebo-controlled, multicenter trial. Journal of the American Academy of Dermatology. 38. 539-47. 10.1016/S0190-9622(98)70114-8.
[16] Grimminger, Friedrich & Mayser, P. & Papavassilis, C. & Thomas, M. & Schlotzer, Ewald & Heuer, K.-U & Führer, D. & Hinsch, K.-D & Walmrath, Dieter & Schill, Wolf-Bernhard & Seeger, W.. (1993). A double-blind, randomized, placebo-controlled trial of n-3 fatty acid based lipid infusion in acute, extended guttate psoriasis. Journal of Molecular Medicine. 71. 634-643. 10.1007/BF00184491.
[17] Gupta, Aditya & Ellis, Charles & TELLNER, D.C. & ANDERSON, T.F. & Voorhees, John. (1989). Double‐blind, placebo‐controlled study to evaluate the efficacy of fish oil and low‐dose UVB in the treatment of psoriasis. British Journal of Dermatology. 120. 801 - 807. 10.1111/j.1365-2133.1989.tb01378.x.
[18] Balbás, G & Sánchez-Rega?a, Manuel & Millet, P. (2011). Study on the use of omega-3 fatty acids as a therapeutic supplement in treatment of psoriasis. Clinical, cosmetic and investigational dermatology. 4. 73-7. 10.2147/CCID.S17220.
[19] Danno, Kiichiro & Sugie, Nobuo. (1998). Combination Therapy with Low-Dose Etretinate and Eicosapentaenoic Acid for Psoriasis Vulgaris. The Journal of dermatology. 25. 703-5. 10.1111/j.1346-8138.1998.tb02487.x.
[20] Clark, C., Taghizadeh, M., Nahavandi, M., & Jafarnejad, S. (2019). Efficacy of ω-3 supplementation in patients with psoriasis: a meta-analysis of randomized controlled trials. Clinical rheumatology, 38(4), 977–988. https://doi.org/10.1007/s10067-019-04456-x
[21] Chen, X., Hong, S., Sun, X., Xu, W., Li, H., Ma, T., Zheng, Q., Zhao, H., Zhou, Y., Qiang, Y., Li, B., & Li, X. (2020). Efficacy of fish oil and its components in the management of psoriasis: a systematic review of 18 randomized controlled trials. Nutrition reviews, 78(10), 827–840. https://doi.org/10.1093/nutrit/nuz098
[22] Yang, Shih-Jyun & Chi, Ching-Chi. (2019). Effects of fish oil supplement on psoriasis: a meta-analysis of randomized controlled trials. BMC Complementary and Alternative Medicine. 19. 10.1186/s12906-019-2777-0.
[23] Zulfakar, M. H., Edwards, M., & Heard, C. M. (2007). Is there a role for topically delivered eicosapentaenoic acid in the treatment of psoriasis?. European journal of dermatology : EJD, 17(4), 284–291. https://doi.org/10.1684/ejd.2007.0201
[24] Katsimbri, Pelagia & Korakas, Emmanouil & Kountouri, Aikaterini & Ikonomidis, Ignatios & Tsougos, Elias & Vlachos, Dionysios & Papadavid, Evangelia & Raptis, Athanasios & Lambadiari, Vaia. (2021). The Effect of Antioxidant and Anti-Inflammatory Capacity of Diet on Psoriasis and Psoriatic Arthritis Phenotype: Nutrition as Therapeutic Tool?. Antioxidants. 10. 157. 10.3390/antiox10020157.
[25] Umar, Meenakshi & Seetharama Sastry, Konduru & Al Ali, Fatima & Al-Khulaifi, Moza & Wang, Ena & Chouchane, Aouatef. (2018). Vitamin D and the Pathophysiology of Inflammatory Skin Diseases. Skin Pharmacology and Physiology. 31. 74-86. 10.1159/000485132
[26] Filoni, Angela & Vestita, Michelangelo & Congedo, Maurizio & Giudice, Giuseppe & Tafuri, Silvio & Bonamonte, Domenico. (2018). Association between psoriasis and vitamin D: Duration of disease correlates with decreased vitamin D serum levels. Medicine. 97. e11185. 10.1097/MD.0000000000011185.
[27] Morimoto, S & Yoshikawa, K & Kozuka, T & Kitano, Y & Imanaka, S & Fukuo, K & Koh, Eunkyung & Kumahara, Y. (1986). An open study of vitamin D3 treatment in Psoriasis vulgaris. The British journal of dermatology. 115. 421-9. 10.1111/j.1365-2133.1986.tb06236.x.
[28] Smith, E & Pincus, S & Donovan, L & Holick, Michael. (1988). A novel approach for the evaluation and treatment of psoriasis. Oral or topical use of 1,25-dihydroxyvitamin D3 can be a safe and effective therapy for psoriasis. Journal of the American Academy of Dermatology. 19. 516-28. 10.1016/S0190-9622(88)70207-8.
[29] Finamor, Danilo & Sinigaglia-Coimbra, Rita & Neves, Luiz & Gutierrez, Marcia & Silva, Jeferson & Torres, Lucas & Surano, Fernanda & Neto, Domingos & Novo, Neil & Juliano, Yara & Lopes, Antonio & Coimbra, Cicero. (2013). A pilot study assessing the effect of prolonged administration of high daily doses of vitamin D on the clinical course of vitiligo and psoriasis. Dermato-endocrinology. 5. 222-34. 10.4161/derm.24808.
[30] Disphanurat, Wareeporn & Viarasilpa, Wongsiya & Chakkavittumrong, Panlop & Pongcharoen, Padcha. (2019). The Clinical Effect of Oral Vitamin D2 Supplementation on Psoriasis: A Double-Blind, Randomized, Placebo-Controlled Study. Dermatology Research and Practice. 2019. 1-9. 10.1155/2019/5237642.
[31] Osmancevic, Amra & Landin-Wilhelmsen, Kerstin & Lark?, Olle & Wennberg, Ann-Marie & Krogstad, Anne-Lene. (2009). Vitamin D production in psoriasis patients increases less with narrowband than with broadband ultraviolet B phototherapy. Photodermatology, photoimmunology & photomedicine. 25. 119-23. 10.1111/j.1600-0781.2009.00418.x.
[32] Jarrett, Paul & Camargo, Carlos & Coomarasamy, Christin & Scragg, Robert. (2017). A randomized, double-blind, placebo-controlled trial of the effect of monthly vitamin D supplementation in mild psoriasis. The Journal of dermatological treatment. 29. 1-18. 10.1080/09546634.2017.1373735.
[33] Ingram, Michelle & Jones, Mary & Jarrett, Paul & Scragg, Robert & Mugridge, Owen & Von Hurst, Pamela. (2018). Oral vitamin D 3 supplementation for chronic plaque psoriasis: A randomized, double-blind, placebo-controlled trial. Journal of Dermatological Treatment. 29. 1-34. 10.1080/09546634.2018.1444728.
[34] Venegas-Iribarren, S., & Andino, R. (2017). Topical corticosteroids or vitamin D analogues for plaque psoriasis?. ?Corticoides tópicos o análogos de vitamina D para la psoriasis en placa?. Medwave, 17(Suppl 2), e6981. https://doi.org/10.5867/medwave.2017.6981
[35] Devaux, S., Castela, A., Archier, E., Gallini, A., Joly, P., Misery, L., Aractingi, S., Aubin, F., Bachelez, H., Cribier, B., Jullien, D., Le Ma?tre, M., Richard, M. A., Ortonne, J. P., & Paul, C. (2012). Topical vitamin D analogues alone or in association with topical steroids for psoriasis: a systematic review. Journal of the European Academy of Dermatology and Venereology : JEADV, 26 Suppl 3, 52–60. https://doi.org/10.1111/j.1468-3083.2012.04524.x
[36] Fogh, K., & Kragballe, K. (2004). New vitamin D analogs in psoriasis. Current drug targets. Inflammation and allergy, 3(2), 199–204. https://doi.org/10.2174/1568010043343930
[37] Winiarska-Mieczan, A., Mieczan, T., & Wójcik, G. (2020). importance of Redox Equilibrium in the Pathogenesis of Psoriasis-Impact of Antioxidant-Rich Diet. Nutrients, 12(6), 1841. https://doi.org/10.3390/nu12061841
[38] Kharaeva, Z., Gostova, E., De Luca, C., Raskovic, D., & Korkina, L. (2009). Clinical and biochemical effects of coenzyme Q(10), vitamin E, and selenium supplementation to psoriasis patients. Nutrition (Burbank, Los Angeles County, Calif.), 25(3), 295–302. https://doi.org/10.1016/j.nut.2008.08.015
[39] RUEDEMANN, R. (1954). Treatment of psoriasis with large doses of vitamin B12, 1,100 micrograms per cubic centimeter; preliminary clinical report. A.M.A. archives of dermatology and syphilology. 69. 738-9.
[40] Baker, Harvey & COMAISH, J. (1963). Is Vitamin B12 of Value in Psoriasis?. British medical journal. 2. 1729-30. 10.1136/bmj.2.5321.1729.
[41] Antiga, Emiliano & Bonciolini, Veronica & Volpi, Walter & Bianco, Elisa & Caproni, Marzia. (2015). Oral Curcumin (Meriva) Is Effective as an Adjuvant Treatment and Is Able to Reduce IL-22 Serum Levels in Patients with Psoriasis Vulgaris. BioMed Research International. 2015. 1-7. 10.1155/2015/283634.
[42] Bahraini, Parichehr & Rajabi, Mehdi & Mansouri, P. & Sarafian, Golnaz & Chalangari, Reza & Azizian, Zahra. (2018). Turmeric tonic as a treatment in scalp psoriasis: A randomized placebo-control clinical trial. Journal of Cosmetic Dermatology. 17. 10.1111/jocd.12513.
[43] Carrion, Miguel & Ramírez-Bosca, Ana & Navarro Lopez, Vicente & Martinez-Andres, Asunción & Asín-Llorca, Manuel & Bernd, August & Horga, Jose. (2015). Effects of Curcuma extract and visible light on adults with plaque psoriasis. European journal of dermatology: EJD. 12. 10.1684/ejd.2015.2584.
[44] Vollono, L., Falconi, M., Gaziano, R., Iacovelli, F., Dika, E., Terracciano, C., Bianchi, L., & Campione, E. (2019). Potential of Curcumin in Skin Disorders. Nutrients, 11(9), 2169. https://doi.org/10.3390/nu11092169
[45] Panahi, Y., Fazlolahzadeh, O., Atkin, S. L., Majeed, M., Butler, A. E., Johnston, T. P., & Sahebkar, A. (2019). Evidence of curcumin and curcumin analogue effects in skin diseases: A narrative review. Journal of cellular physiology, 234(2), 1165–1178. https://doi.org/10.1002/jcp.27096
[46] Pleńkowska, J., Gabig-Cimińska, M., & Mozolewski, P. (2020). Oxidative Stress as an important Contributor to the Pathogenesis of Psoriasis. International journal of molecular sciences, 21(17), 6206. https://doi.org/10.3390/ijms21176206
#銀屑病解疑##皮膚健康科普##生物制劑#

張龍東
