
科技改變生活 · 科技引領未來

科技改變生活 · 科技引領未來
雖然新冠疫情仍在持續,但國際上對新藥的審批和上市卻絲毫沒有放慢腳步,我們匯總了第二季度獲得FDA、NMPA批準的抗腫瘤相關藥物,其中FDA共批準了32款抗腫瘤藥物,9款為新藥上市,21款為新增適應癥;NMPA共批準了10款抗腫瘤藥物,5款為
雖然新冠疫情仍在持續,但國際上對新藥的審批和上市卻絲毫沒有放慢腳步,我們匯總了第二季度獲得FDA、NMPA批準的抗腫瘤相關藥物,其中FDA共批準了32款抗腫瘤藥物,9款為新藥上市,21款為新增適應癥;NMPA共批準了10款抗腫瘤藥物,5款為新藥上市,4款為新增適應癥,所覆蓋領域包括非小細胞肺癌、乳腺癌、結直腸癌、膽管癌、胃腸道間質瘤等多個癌種。越來越多靶向藥物的獲批上市助力了腫瘤精準醫學的快速發展,也為晚期腫瘤患者帶來了更多的福音。
FDA獲批
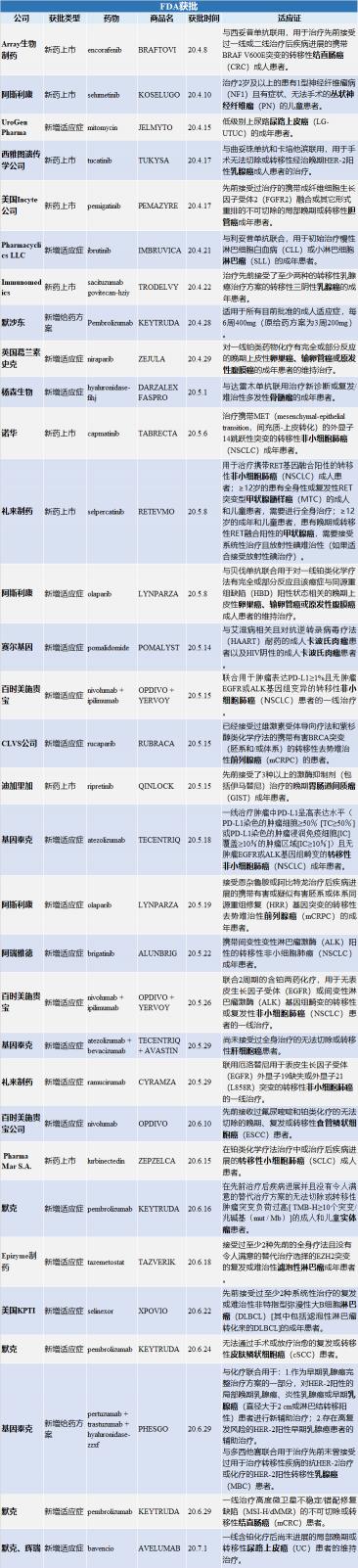
(詳情請點擊查看原圖)
NMPA獲批
FDA新藥上市
01【Array生物制藥】
康奈菲尼(encorafenib,商品名:BRAFTOVI)
與西妥昔單抗聯用,用于治療先前接受過一線或二線治療后疾病進展的攜帶BRAF V600E突變的轉移性結直腸癌(CRC)成人患者。
臨床試驗:BEACON CRC(NCT02928224)
患者情況:采用隨機、多中心、主動控制、開放標簽的臨床試驗,招募先前接受過一線或二線治療后疾病進展的攜帶BRAF V600E突變的轉移性結直腸癌(CRC)患者。對入組患者進行隨機分配,試驗組(220例)接受“康奈菲尼(300 mg 口服 qd)+西妥昔單抗”聯合治療,對照組(221例)接受“伊立替康+西妥昔單抗”聯合治療。
療效數據:
“康奈菲尼+西妥昔單抗”試驗組的中位OS為8.4個月(95% CI: 7.5, 11.0),對照組為5.4個月(95% CI:4.8,6.6,HR=0.60,95% CI: 0.45,0.79,p=0.0003)。試驗組的中位PFS為4.2個月(95% CI:3.7,5.4),對照組為1.5個月(95% CI:1.4,1.7,HR=0.40,95%CI:0.31,0.52,p<0.0001)。
試驗組與對照組的ORR分別為20%(95% CI: 13%,29%)和2%(95% CI: 0%,7%)。
試驗組的中位DOR為6.1個月(95% CI: 4.1,8.3),對照組未達到中位DOR(95% CI: 2.6, NR)。
不良反應:最常見的不良反應(≥25%)為疲勞,惡心,腹瀉,痤瘡性皮膚炎,腹痛,食欲下降,關節痛和皮疹。
02【阿斯利康】
司美替尼(selumetinib,商品名:KOSELUGO)
用于治療2歲及以上的患有1型神經纖維瘤病(NF1)且有癥狀的、無法手術的叢狀神經纖維瘤(PN)的兒童患者。
臨床試驗:SPRINT(NCT01362803)
療效數據:患者每日兩次口服selumetinib單藥治療,結果顯示,客觀緩解率(ORR)達到了66%(n = 33/50;95%CI:51,79)。所有患者都有部分緩解(PR),反應持續時間(DoR)≥12個月的患者高達82%。
不良反應:最常見的不良反應(≥40%)是嘔吐,皮疹,腹痛,腹瀉,惡心,皮膚干燥,疲勞,肌肉骨骼疼痛,發燒,痤瘡,口腔炎,頭痛,甲溝炎和瘙癢。
03【西雅圖遺傳學公司】
圖卡替尼(tucatinib,商品名:TUKYSA)
與曲妥珠單抗和卡培他濱聯用,用于手術無法切除或轉移性經治晚期HER-2陽性乳腺癌成人患者的治療。
臨床試驗:HER-2CLIMB(NCT02614794)
患者情況:招募了612例先前接受過曲妥珠單抗、帕妥珠單抗和曲妥珠單抗-美坦新偶聯物治療的HER-2陽性轉移性乳腺癌患者。試驗組(410例)患者接受“圖卡替尼(300mg bid)+曲妥珠單抗+希羅達”治療;對照組(202例)患者接受“安慰劑+曲妥珠單抗+希羅達”治療。
療效數據:
試驗組患者(接受圖卡替尼治療)的中位PFS為7.8個月(95% CI: 7.5,9.6),對照組患者為5.6個月(95% CI: 4.2,7.1),HR=0.54(95% CI:0.42,0.71,P<0.00001)。試驗組的中位OS為21.9個月(95% CI: 18.3,31.0),對照組為17.4個月(95% CI: 13.6,19.9),HR=0.66(95% CI:0.50,0.87,P=0.00480)。
試驗組和對照組的可測量疾病患者的確定ORR分別為40.6%(95% CI: 35.3,46.0)和22.8%(95% CI: 16.7,29.8)(p=0.00008)。
不良反應:最常見的不良反應(≥20%)是腹瀉,掌-跖紅腫,惡心,疲勞,肝毒性,嘔吐,口腔炎,食欲下降,腹痛,頭痛,貧血和皮疹。圖卡替尼還可引起嚴重的腹瀉和肝毒性。
04【美國Incyte公司】
培米加替尼(pemigatinib,商品名:PEMAZYRE)
用于先前接受過治療的攜帶成纖維細胞生長因子受體2(FGFR2)融合或其它形式重排的不可切除的局部晚期或轉移性膽管癌成年患者。pemigatinib是全球首個并且唯一一個獲批上市的膽管癌靶向藥物。
臨床試驗:FIGHT-202(NCT02924376)
患者情況:多中心、開放標簽、單臂臨床試驗,招募了107名無法切除的局部晚期或轉移性膽管癌患者,患者接受“培米加替尼(Pemigatinib) 13.5mg 口服 每日一次”治療,連續口服14天,之后停藥7天。
療效數據:
以總體反應率(ORR)和反應持續時間為主要療效結果指標。在107例患者中,ORR為36%(95% CI: 27%,45%),其中包括3例完全緩解。中位DOR為9.1個月,38例患者中有24例(63%)反應持續時間≥6個月,有7例患者(18%)的反應持續時間≥12個月。
不良反應:最常見的不良反應(≥20%)是高磷血癥,脫發,腹瀉,指甲毒性,疲勞,消化不良,惡心,便秘,口腔炎,干眼,口干,食欲下降,嘔吐,關節痛,腹痛,低磷血癥,背部疼痛和皮膚干燥。眼毒性和高磷血癥是培馬加替尼的重要風險。
05【Immunomedics公司】
sacituzumab govitecan-hziy(商品名:TRODELVY)
用于治療先前接受了至少兩種的轉移性乳腺癌治療方案的轉移性三陰性乳腺癌的成年患者。
臨床試驗:IMMU-132-01(NCT 01631552)
患者情況:多中心、單臂臨床試驗,108名入組患者患者在21天的治療期內,第1和8天接受sacituzumab govitecan-hziy治療,治療劑量為10mg/kg。每8周進行一次腫瘤成像,患者接受治療直至疾病進展或不能耐受治療。
療效數據:整體緩解率(ORR)為33.3%(95% CI: 24.6,43.1)。中位反應持續時間為7.7個月(95% CI: 4.9,10.8)。
不良反應:最常見的不良反應(≥25%)為惡心,中性粒細胞減少,腹瀉,疲勞,貧血,嘔吐,脫發,便秘,皮疹,食欲下降和腹痛。Sacituzumab govitecan-hziy還可引起嚴重的中性粒細胞減少和腹瀉。
06【諾華】
卡馬替尼(capmatinib,商品名:TABRECTA)
用于治療攜帶MET(mesenchymal-epithelial transition,間充質-上皮轉化)的外顯子14跳躍性突變的轉移性非小細胞肺癌(NSCLC)成年患者。
臨床試驗:GEOMETRY mono-1 trial (NCT02414139)
患者情況:
多中心、非隨機、開放標簽、多隊列研究,招募97位確定攜帶MET外顯子14跳躍性突變的轉移性NSCLC患者,患者接受“卡馬替尼 400mg PO bid”治療,直至疾病進展或者出現無法耐受的毒性。
療效數據:
在28名初治患者中,ORR為68%(95%CI:48,84),反應持續時間為12.6個月(95%CI:5.5,25.3)。在既往接受過治療的69位患者中,ORR為41%(95%CI:29,53),反應持續時間為9.7個月(95%CI:5.5,13.0)。
不良反應:最常見的不良反應(≥20%)是周圍水腫,惡心,疲勞,嘔吐,呼吸困難和食欲下降。卡馬替尼還可引起間質性肺疾病,肝毒性,光敏性和胚胎胎兒毒性。
07【禮來制藥】
selpercatinib(商品名:RETEVMO)
1.攜帶RET基因融合陽性的轉移性非小細胞肺癌(NSCLC)成人患者;
2.≥12歲的患有全身性或復發性RET突變型甲狀腺髓樣癌(MTC)的成人和兒童患者,需要進行全身治療;
3.≥12歲的成年和兒童患者,患有晚期或轉移性RET融合陽性的甲狀腺癌,需要接受系統性治療且放射性碘難治性(如果適合接受放射性碘治療)。
臨床試驗:LIBRETTO-001
患者情況:多中心、開放標簽、多隊列臨床試驗,使用NGS、PCR或熒光原位雜交法前瞻性地確定RET基因改變的鑒定。
療效數據:
1.在105例既往接受過鉑類藥物化療的RET融合陽性NSCLC成人患者中,整體的客觀緩解率(ORR)為64%。在獲得緩解的患者中,81%的患者持續緩解時間(DOR)至少為6個月。該研究還對39例RET融合陽性NSCLC初治患者進行了療效評價,ORR為84%,58%獲得緩解的患者的DOR至少為6個月。
2.在≥12歲的攜帶RET突變的MTC成人和兒童患者中,88例初治患者中,ORR為73%,61%獲得緩解的患者DOR至少為6個月。55例經治患者的ORR為69%,76%獲得緩解的患者DOR至少為6個月。
3.在治療≥12歲的RET融合陽性甲狀腺癌成人和兒童患者時,19例接受過放射性碘治療和至少一種其它療法治療的患者的ORR為79%,87%獲得緩解的患者DOR至少為6個月。8例只接受過放射性碘治療的患者的ORR為100%,75%獲得緩解的患者DOR至少6個月。
不良反應:最常見的不良反應(≥25%)包括實驗室異常(天冬氨酸轉氨酶增加、丙氨酸轉氨酶增加、葡萄糖增加、白細胞減少、白蛋白減少、鈣減少、肌酐增加、堿性磷酸酶增加、血小板減少、總膽固醇增加)、高血壓、疲勞、水腫、皮疹和便秘。
08【迪加里加制藥公司】
瑞普替尼(ripretinib,商品名:QINLOCK)
用于治療先前接受了3種以上的激酶抑制劑(包括伊馬替尼)治療的晚期胃腸道間質瘤(GIST)成年患者。
臨床試驗:INVICTUS(NCT03353753)
患者情況:多中心、隨機(2:1)、雙盲試驗。試驗組患者接受“瑞普替尼 150mg PO qd”治療,對照組患者口服安慰劑,直至疾病進展或者出現無法耐受的毒性。
療效數據:
與對照組(口服安慰劑)相比,試驗組(口服瑞普替尼)的PFS在統計學上有顯著改善(HR 0.15; 95% CI: 0.09,0.25; p<0.0001)。試驗組的中位PFS為6.3個月(95% CI: 4.6,6.9),而對照組為1.0個月(95% CI: 0.9,1.7)。試驗組的ORR為9%(95% CI: 4.2,18),而對照組為0%(95% CI: 0,8)。試驗組的中位OS為15.1個月(95% CI: 12.3,15.1),對照組為6.6個月(95% CI: 4.1,11.6),HR=0.36(95% CI: 0.21,0.62)。
不良反應:最常見的不良反應(≥20%)為脫發,乏力,惡心,腹痛,便秘,肌痛,腹瀉,食欲下降,掌-跖紅斑和嘔吐。瑞普替尼的其他重要風險包括新發的原發性皮膚惡性腫瘤,高血壓和心臟功能障礙。
09【Pharma Mar S.A.】
lurbinectedin(商品名:ZEPZELCA)
用于治療在鉑類化學療法治療中或治療后疾病進展的轉移性小細胞肺癌(SCLC)成人患者。
臨床試驗:PM1183-B-005-1(NCT02454972)
患者情況:多中心、開放標簽、多隊列的臨床試驗,105名患者患者接受"Lurbinectedin 3.2 mg/m2靜脈輸注q3w"治療,直至疾病進展或出現無法接受的毒性。
療效數據:在105例患者中,ORR為35%(95%CI:26%,45%),中位反應持續時間(DoR)為5.3個月(95%CI:4.1、6.4),獨立審查委員會(IRC)評估的ORR為30%(95%CI:22%,40%),中位DoR為5.1個月(95%CI:4.9,6.4)。
不良反應:最常見的不良反應(≥20%)、包括實驗室異常(骨髓抑制、乏力、肌酐增加、丙氨酸轉氨酶增加、葡萄糖增加)、惡心、食欲下降、肌肉骨骼疼痛、白蛋白減少、便秘、呼吸困難、鈉減少、天冬氨酸增加氨基轉移酶、嘔吐、咳嗽、鎂減少和腹瀉。
NMPA新藥上市
01【北海康成】
馬來酸奈拉替尼(商品名:賀儷安)
用于接受過曲妥珠單抗輔助治療之后的HER-2陽性的早期乳腺癌成年患者的強化輔助治療。
獲批背景:
奈拉替尼是全球首個且唯一用于HER-2陽性早期乳腺癌強化輔助治療的小分子藥物,其作用靶點廣泛,通過胞內不可逆結合,同時抑制HER1/HER-2/HER4信號通路。在ExteNET的III期研究中,5年隨訪數據表明:患者在接受曲妥珠單抗治療后,繼續口服一年奈拉替尼進行強化輔助治療,能夠降低27%的復發風險,而對于同時具有雌激素/孕激素受體陽性(ER/PR 陽性)的患者,使用奈拉替尼能夠降低5年復發風險達42%,獲益更為顯著。
02【武田制藥】
注射用維布妥昔單抗(商品名:安適利)
用于治療成人CD30陽性的復發或難治性系統性間變性大細胞淋巴瘤(sALCL)和經典型霍奇金淋巴瘤(cHL)。
獲批背景:
維布妥昔單抗在中國的獲批是基于三項臨床研究SG035-0004、SG035-0003、C25007的數據。在SG-035-0004研究中,針對復發或難治性間變大細胞淋巴瘤,58例患者中97%的復發或難治性系統性間變性大細胞淋巴瘤患者可實現腫瘤縮小,其5年生存率提高至60%;在SG035-0003研究中,94%的復發或難治性經典型霍奇金淋巴瘤的患者可實現腫瘤縮小,其中位總生存期(mOS)從歷史27.6個月提升至40.5個月;在C25007研究中,在既往至少接受一次化療方案且開始維布妥昔單抗治療時不適合進行干細胞移植(SCT)或多藥化療的復發或難治性經典型霍奇金淋巴瘤患者(n=60)中,客觀緩解率(ORR)為50%(95% CI,37: 63%)
03【百濟神州】
澤布替尼膠囊(商品名:百悅澤)
用于治療:
1.復發/難治性(R/R)套細胞淋巴瘤(MCL)患者;
2.R/R慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)患者。
獲批背景:
I期BGB-3111-206研究數據顯示,澤布替尼用于治療復發/難治性(R/R)MCL的ORR達84%,包括59%的完全緩解以及24%的部分緩解。III期SEQUOIA研究C組數據顯示,澤布替尼對于17p染色體缺失的初治CLL/SLL患者ORR達92.7%,部分緩解(PR)率為78.9%,伴有淋巴細胞增多的PR率為11.9%,完全緩解(CR)率為1.9%。
04【信達生物】
貝伐珠單抗(商品名:達攸同)
用于治療晚期非鱗非小細胞肺癌和轉移性結直腸癌。
獲批背景:
達攸同抗腫瘤的原理機制是通過阻斷血管內皮生長因子VEGF,抑制腫瘤的血管新生,切斷腫瘤區域的供血,抑制腫瘤的生長和轉移,誘導腫瘤細胞凋亡,從而達到抗腫瘤的治療效果。這是信達生物繼達伯舒 (信迪利單抗注射液)之后第二個上市的單克隆抗體藥物,并且信達生物正在進行的達攸同聯合達伯舒治療晚期肝細胞癌的Ib期初步臨床試驗結果,將于今年ASCO年會上公布。
05【三生國健】
注射用伊尼妥單抗(商品名:賽普汀)
聯合化療用于治療HER-2陽性的轉移性乳腺癌。
獲批背景:
這是中國自主研發上市的首個創新抗HER-2單抗藥物。體外研究顯示,伊尼妥單抗的Fab段與曲妥珠單抗一致,通過Fc段修飾和生產工藝優化,具有更強ADCC效應,更好地實現了抗HER-2單抗藥物的治療目標——既可以阻斷HER-2通路,直接抑制腫瘤細胞增殖和生長;又可以誘導ADCC效應,通過機體免疫系統識別和殺傷腫瘤細胞。

馬陽一
