
科技改變生活 · 科技引領未來

科技改變生活 · 科技引領未來
(報告出品方/作者:渤海證券,陳晨)1.新型抗腫瘤藥物大放異彩1.1癌癥患者持續增加全球人口老齡化加劇,癌癥患者急劇增加。據世衛組織國際癌癥研究機構(IARC)發布的2020年全球最新癌癥負擔數據,2020年全球新發癌癥病例1929萬例,癌
(報告出品方/作者:渤海證券,陳晨)
1.新型抗腫瘤藥物大放異彩
1.1 癌癥患者持續增加
全球人口老齡化加劇,癌癥患者急劇增加。據世衛組織國際癌癥研究機構(IARC) 發布的 2020 年全球最新癌癥負擔數據,2020 年全球新發癌癥病例 1929 萬例, 癌癥死亡病例 996 萬例,預計 2040 年的全球新發癌癥病例數將達到近 3000 萬,癌癥負擔將比 2020 年增加 50%。
新發癌種方面,2020 年全球乳腺癌新發病例(226 萬)超過肺癌(220 萬)成為全球 第一大癌,其次是結直腸癌(CRC,193 萬)、前列腺癌(141 萬)、CA(109 萬)、 HC(91 萬)、宮頸癌(60 萬),前十大癌種占據新發癌癥的 63%;死亡癌種方面, 肺癌依舊為第一大致死癌癥,為 180 萬例,其次是 CRC(94 萬)、HC(83 萬)、 CA(77 萬)、乳腺癌(68 萬),前十大癌癥占據癌癥死亡總數的 71%。
我國新發/死亡癌癥病例遠超其他國家,癌癥發病率處于全球中等水平。2020 年我國新發癌癥病例 457萬例,約為全球的23.7%,癌癥死亡病例約300 萬例, 占癌癥死亡總人數 30.2%,均遠超全球其他國家,據米內網數據,近 10 多年我 國惡性腫瘤發病率每年保持約 3.9%的增幅,死亡率每年保持 2.5%的增幅,據 Frost & Sullivan 預測,預計 2030 年我國癌癥新發病例數預計將達到 570 萬例。 國際腫瘤研究中心對全球 20 個地區的腫瘤發病分析數據,我國腫瘤世標發病率 分別為男性 223/10 萬人,女性 183/10 萬人,死亡率分別為男性 167/10 萬人, 女性 95/10 萬人,處于全球各地區中部位置。
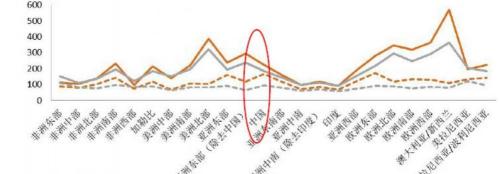
據 IARC 數據,2020 年我國肺癌新發病例最高,其次是 CRC(56 萬)、CA(48 萬)、 乳腺癌(42 萬)、HC(41 萬),前十大癌癥占新發癌癥數的 78%;肺癌死亡人數遙 遙領先,約 71 萬,占癌癥死亡總數的 23.8%,其次是 HC(39 萬)、CA(37 萬)、 食管癌(30 萬)、CRC(29 萬),前十大癌癥約占癌癥死亡總數的 83%。由于我國 人種、生活方式及經濟發展等和發達國家不同,癌譜存在明顯差異,HC、CA、 食管癌等預后較差的消化系統腫瘤高發,而歐美國家則是以甲狀腺癌、乳腺癌和 前列腺癌等雨后較好的腫瘤為主,此外由于我國癌癥早篩率低、臨床診治不規范、 新藥可及性低等因素,預后較好的腫瘤如乳腺癌(82.0%)、甲狀腺癌(84.3%)、前 列腺癌(66.4%)的 5 年生存率仍遠低于美國等發達國家(90.9%、98%、99.5%)。
1.2 全球新型抗腫瘤藥物大放異彩
癌癥治療包括手術、放療、化療、分子靶向治療、腫瘤免疫療法、細胞療法等, 手術治療適用于部分惡性實體瘤,但無法應用于轉移性惡性腫瘤,放化療為更多 癌癥適應癥帶來可及的療法,但伴隨著不可避免的副作用。靶向治療藥物能夠抑 制癌癥特定基因、蛋白質、或有助于癌癥生長或生存的微環境等,從而抑制或阻 斷腫瘤進展,較傳統化療藥物安全性更高、副作用更少,癌癥治療已逐步由化療 藥物演變至分子靶向藥物再至免疫治療。
全球新型抗腫瘤藥物大放異彩。靶向治療通常分為抗體類藥物以及小分子靶向 藥,可作用于腫瘤細胞生長信號、腫瘤血管生成、腫瘤免疫逃逸等不同類別,免 疫治療則是通過提高腫瘤細胞的免疫原性,激發和增強機體抗腫瘤免疫應答,進 而抑制腫瘤的生長,毒副作用小、療效明顯。2019 年全球 top20 抗腫瘤用藥方 面,十余種為針對特定基因突變的靶向藥物,默克的帕博利珠單抗以 110.8 億美 元的銷售規模位列首位。
1.3 群策群力,我國抗腫瘤新藥市場蓬勃發展
醫保對接,加速提升抗腫瘤新藥可及性。醫保談判品種多為新上市且臨床價值較 高、價格相對較高的創新藥或獨家品種。2016 年醫保談判僅納入吉非替尼、埃克 替尼兩款靶向藥物,此后每年一輪談判,在 2020 年醫保談判中,2017 年的談判 抗癌藥物除舒尼替尼、阿法替尼直接納入乙類醫保,其余續談,并新增 17 種抗 癌藥,均為治療血液腫瘤和實體腫瘤所必需的臨床價值高、創新性高、病人獲益 高的藥品。2020 上半年盡管在疫情的沖擊下,公立醫療機構藥品銷售額為 5752 億元,同比下降 13.9%,但醫保談判品種銷售額同比增長 47.11%,逆勢上漲, 比重由去年同期的 2.8%上升至 4.8%,以價換量患者用藥滲透率快速提升。
國產靶向創新藥物加速獲批。據米內網數據,截止 1 月 20 日,我國按照新 1 類 獲批生產且已上市的抗腫瘤新藥有 16 個,除 4 個 PD-1 單抗外其余均為小分子藥 物,近三年來靶向抗腫瘤藥物加速獲批。
疊加一級市場資本追捧及 IPO 注冊制推行,企業新藥研發動力持續激活。據藥 智數據統計,2020 年 CDE 共受理 1 類創新藥受理號 1240 個(其中報臨床 1149 個,報生產 48 個),獲批準的 1096 個,創歷史新高。2019 年 IND 新藥數據顯 示,抗腫瘤新藥在化學創新藥、生物創新藥均占據絕對數量,我們認為這一趨勢延續。
我國靶向抗腫瘤藥物市場快速擴容。據米內網數據,2019 年,抗腫瘤藥物在城 市公立醫院腫瘤藥物銷售規模為 957 億元(以下涉及單品或單類銷售規模來源均 為城市公立醫院),同比增長 20.9%,2020 年上半年銷售規模為 519 億元,其中 以靶向藥為主的蛋白激酶抑制劑和單克隆抗體藥物占據市場近 50%份額。
靶向抗腫瘤藥物自 2014 年以來復合增速高達 33%,以替尼為代表的蛋白激酶抑 制劑在抗腫瘤化學藥市場中的份額從 2017 年的 13.62%上漲至 2019 年的 21.22%,以單抗為代表的單克隆抗體也從 2017 年的 12.87%上漲至 2019 年的 18.93%,上漲勢頭明顯。
截止 2 月 24 日,共計 23 個用于腫瘤治療的單抗藥物在國內上市(含類似物),包 括 10 個進口單抗,以靶向 PD-1/L1、HER2、CD20、VEGF 為主。
2019 年,單抗類抗腫瘤藥物銷售規模為 171.83 億元,自 2015 年以來復合增速 高達 32.95%,增速居抗癌藥首位,2020 年上半年在疫情沖擊下仍保持 48.68% 的增速水平,top20 靶向藥物幾乎占據市場 100%份額,其中前三大曲妥珠單抗、 利妥昔單抗以及貝伐珠單抗超過市場一半份額,集中度高。
小分子靶向藥物方面,據米內網數據,截至 2021 年 1 月 20 日,我國已獲批生產 的蛋白激酶抑制劑共計四十余個,其中按 1 類申報生產獲批的國產蛋白激酶抑制 劑共計 14 個,靶點覆蓋方面以 EGFR、ALK、BCR-ABL 等居多。2019 年在城 市公立醫院市場規模為 185.48 億元,自 2015 年以來復合增速高達 32.66%,居 抗癌藥第一大類(21.50%),2020年上半年在疫情沖擊下仍保持44.97%的增速水 平,適應癥以肺癌、CRC、血液癌、乳腺癌等大癌種為主,top20 靶向藥物占據 市場的 93.65%。據 Frost & Sullivan 的預測,2023 年我國小分子靶向藥市場將 達到 264.5 億元。
此外,我國已有1款雙抗體藥物、2款ADC藥物均通過優先審評審批通道獲批上 市,新型抗癌藥物體系持續豐富中。
2.EGFR:紅海靶點,新一代 TKI 待出
表皮生長因子受體(EGFR)是表皮生長因子受體家族中的一員,位于第 7 號染色 體短臂上,EGFR 基因共計 28 個外顯子,其中 19 外顯子缺失突變和 21 外顯子 L858R 點突變約占 EGFR 基因突變的 90%,激活后的 EGFR 可以磷酸化下游蛋 白 , 調 控 細 胞 存 活 的 PI3K-AKT-mTOR 信 號 通 路 和 細 胞 增 殖 的 RAS-RAF-MEK-ERK 信號通路,EGFR 在許多上皮來源的腫瘤中過表達,如 NSCLC、乳腺癌、腦膠質瘤、頭頸癌、宮頸癌、膀胱癌、CA 等,其中肺癌最為 常見。
2.1 小分子:一二代 EGR-TKI 呈紅海,三四代紛至沓來
NSCLC 約占 85%,包括鱗癌、腺癌、大細胞癌,我國大部分 NSCLC 患者的外 顯子 19 或 21 常發生突變(分別占 45%和 40%),高于美國和歐洲肺癌 EGFR 突 變率 (10%-15%)。
國內已經批準上市三代 EGFR-TKI,均被 NMPA 批準用于一線 EGFR 突變陽性 晚期 NSCLC 患者的治療,二代 TKI(阿法替尼、達克替尼)相比于一代(吉非替 尼、厄洛替尼、埃克替尼)能不可逆的與 EGFR 突變蛋白結合,理論上抑制效果 更好、更持久,但一二代 TKI 最終會在 9-14 個月產生耐藥,其中約 50%患者產 生 T790M 位點突變,三代奧希替尼能夠有效作用于 EGFRm/EGFR T790M 突變 陽性形式的 EGFR,且對野生型 EGFR 的活性很低, 2020 年 3 月,豪森藥業三 代阿美替尼獲批上市,作為 T790M 突變經 EGFR-TKI 治療失敗的晚期 NSCLC 二線治療藥物,近日艾力斯三代伏美替尼已獲批上市,貝達藥業三代貝福替尼上 市申請獲受理。
阿斯利康的甲磺酸奧希替尼于 2015 年 11 月獲 FDA 批準,2017 年國內上市, 2019 年 8 月獲批準用于 EGFR 陽性晚期 NSCLC 的一線治療,在一項與其他 EGFR-TKI 對照的針對首治 EGFR-NSCLC 的全球實驗中,奧希替尼組與對照組 的中位無進展生存期(mPFS,主要療效終點)分別為 18.9、10.2 個月,其中中國 隊列 mPFS 分別是 17.8、9.8 個月,且對中樞神經系統轉移患者(CNS)療效更佳。
除達克替尼外,其余 6 大 EGFR-TKI 均已納入醫保,其中吉非替尼(250mg)為首 批集采品種,阿斯利康(4+7 及擴圍中標價格為 54.7 元)、齊魯制藥(擴圍 25.7 元)、正大天晴(擴圍 45 元)中標,2020 年上半年城市公立醫院銷售規模(為 17.15 億元,同比下降26.27,奧希替尼為我國第一大靶向抗癌藥,2020年上半年銷售 規模為 16.42 億元,同比增長 98.62%。
截止 2 月 19 日,正大天晴、揚子江、創諾制藥等的吉非替尼仿制藥物已獲批上 市,且有美大康華、重慶佳世騰、白云山等五家企業新分類注冊報產中,厄洛替 尼、阿法替尼均已有品種以新注冊分類上市。
除以上市EGFR-TKI外,艾森生物的艾維替尼和貝達藥業的貝福替尼均處于上市 申請中,其均為三代 EGFR-TKI,作用于 EGFR T790M,益方生物、潤新生 物、倍而達藥業等適用于 NSCLC 的 EGFR-TKI 均處于臨床 III 期,預計未來市場 競爭較為激烈。此外正大天晴的 TQB3804 尚處于 I 期,其為四代 EGFR-TKI,用 于三代耐藥后的進一步治療,約 15%的 EGFR 突變 NSCLC 患者在接受第三代 EGFR-TKI 治療后發生 C797S 突變,療效需進一步驗證。
2.2 大分子:在研豐富,西妥昔單抗類似藥即將噴涌
國內已獲批上市的 EGFR 類單抗藥物包括西妥昔單抗和尼妥珠單抗。
默克的西妥昔單抗為嵌合型 lgG1 單抗,與 EGFR 結合的親和力約為其內源性配 體的 5-10 倍,還可以靶向誘導細胞毒免疫效應細胞作用于表達 EGFR 的腫瘤 細胞(即抗體依賴細胞介導的細胞毒作用,ADCC),臨床試驗中療效顯著。
2018 年西妥昔單抗納入醫保談判品種,報銷范圍為單用或與伊立替康聯用于 EGFR 過表達的對以伊立替康為基礎的化療方案耐藥的轉移性直腸癌的治療,推 薦起始劑量為 400mg/m2,維持劑量為一周 250mg/m2,最新公布中標價格為 1295 元/100mg,與伊立替康聯用初治轉移性 CRC 患者至病情進展期(約 11.2 月),用藥金額約為24萬元,用于伊立替康耐藥后使用至病情進展期(約3.5月), 用藥金額約為 7.56 萬元(醫保報銷范圍)。2019 年城市公立醫院銷售規模達 11.99 億元,同比增長 68.78%,2020 年醫保續談判成功,2020 年上半年銷售規模約 8.30 億元,受疫情影響下降 30.77%。
西妥昔單抗在我國專利保護于 2017 年 1 月到期,截止 2021 年 2 月 19 日,處于 臨床 III 期、II 期的 EGFR 單抗類產品分別有 6、4 個,其中齊魯制藥、安進制 藥、邁博太科、海正藥業、安普澤、科倫藥業進度領先,除海正藥業外,其余均 用于轉移性 CRC 的治療,未來可能面臨集采壓力。
3.ALK/ROS1:阿來替尼療效顯著,潛在品種 壓力較大
ALK 是一種間變性淋巴瘤激酶,約 5%NSCLC 患者存在 ALK 基因重排陽性,在 年輕、不吸煙且 EGFR 未突變的肺腺癌患者中表達率可達 25%-30%,病理類型 為含印戒細胞的粘液型或實性腺癌中,ALK 融合發生率達到 46.2%。
ALK 靶向藥包括一代克唑替尼、二代塞瑞替尼、阿來替尼、布加替尼以及三代 勞拉替尼等,2020CSCO 指南 I 級推薦阿來替尼(優先推薦)、克唑替尼用于 IV 期 ALK 融合 NSCLC 的一線治療(1A 類證據),阿來替尼、色瑞替尼可用于二線耐藥 后療法,此外克唑替尼也被一級推薦用于 IV 期ROS1 融合的NSCLC 一線治療(1 類證據)。目前塞瑞替尼、克唑替尼、恩沙替尼、阿來替尼、阿來替尼均已在國 內上市,且均已被納入醫保談判,三代勞拉替尼處于 III 期實驗中。
阿來替尼的全球多中心三期臨床試驗 ALEX 研究顯示的 PFS 可達 34.8 個月,相 比克唑替尼組(10.9 個月)提高了 3 倍,降低 57%疾病進展或死亡風險的同時具有 更有的安全性;勞拉替尼可有效對抗各類 ALK 繼發的耐藥基因突變,并且有較 強的中樞神經系統滲透性,保持腦組織中較高的血藥濃度;貝達藥業的恩沙替尼 同時能覆蓋一、二代 ALK 抑制劑常見的耐藥位點,全球多中心一線研究初步結 果顯示,經 BIRC 評估恩沙替尼組 mPFS(ITT)為 25.8 個月,相比克唑替尼 12.7個月顯著延長,同時具有較好的安全性。
阿來替尼憑借突出的臨床療效迅速放量,2020 年上半年實現 4.84 億元的銷售業 績,遠超去年全年 1.39 億元,克唑替尼、塞瑞替尼均快速放量。
截止 2021年 2月 19日,多家企業的ALK/ROS類藥物處于臨床 III期、II期階段, 其中齊魯制藥、正大天晴進度領先,均為與克唑替尼對照下治療 ALK 陽性晚期 NSCLC的頭對頭研究,由于已上市 ALK 抑制劑已表現出良好的mPFS,后續上 市品種將面臨較大的市場競爭壓力。
4.BRAF V600/MEK:達拉非尼+曲美替尼聯用于黑色素瘤療效顯著
我國惡性黑色素瘤發病率約 0.6-1/10 萬(澳大利亞超 50/10 萬;美國約 30/10 萬), 除早期手術切除外,缺乏特效治療,預后差,目前應用于晚期黑色素瘤的化療藥 物主要包括達卡巴嗪、替莫唑胺、紫杉醇、白蛋白紫杉醇、順鉑/ 卡鉑、福莫司 汀。我國黑色素瘤患者的 BRAF 突變率為 20%-25%、KIT 突變率約為 10%,目 前我國上市的針對黑色素瘤靶向藥主要有達拉非尼、維羅非尼、曲美替尼。
2017 年 3 月,維莫非尼在國內上市,在一項針對初治 BRAF V600 突變陽性的 不可切除或轉移性黑色素瘤患者的 III 期臨床研究中,維莫非尼組相對于對照組 (達卡巴嗪組),在 ORR(57%vs9%)、mOS(13.6vs 9.7)、mPFS(6.9vs1.6)具有顯 著的臨床獲益。
曲美替尼靶向作用于 MEK1/2,通過對 MEK 蛋白的作用影響 Ras/Raf/MEK/ERK 信號通路進而抑制細胞增殖,2013 年 5 月獲 FDA 批準上市,2019 年 12 月我 國批準 BRAF 抑制劑達拉非尼聯合 MEK 抑制劑曲美替尼上市,聯合用藥有效率 超 60%。2020CSCO 指南中診療指南中將達拉非尼聯合曲美替尼治療轉移或不 可切除 III/IV 期皮膚黑色素瘤方案由二級推薦升級為一級推薦,2020 版 NCCN 指南推薦達拉非尼+曲美替尼+西妥昔單抗用于 RAS 野生/BRAF V600E 突變的 CRC 二線及二線以后治療。
維莫非尼于 2018 年醫保談判成功,2019 年業績飛速增長,2020 年上半年銷售 規模為 1.44 億元,同比增長 69.19%,2020 年醫保續談成功,有望再度加速放 量;達拉非尼需聯合曲美替尼治療 BRAFV600 突變陽性不可切除或轉移性黑色 素瘤患者,直至出現疾病進展或不可耐受的毒性反應,高昂的用藥費用限制了該 類療法的使用,2020 年上半年達拉非尼在城市公立醫院銷售規模僅約 21 萬元, 達拉非尼與曲美替尼與 2020 年醫保談判成功,將加速該類療法適用。
目 前 , 我 國 臨 床 用 于 黑 色 素 瘤 的 臨 床 試 驗 較 少 ,其中 百 濟 神 州 的 Lifirafenib(BGB-283)是一款新型具有 RAF 單體和二聚體抑制活性的在研小分 子激酶抑制劑,已在臨床前模型、攜帶 V600E 型 BRAF 突變及非 V600E 型 BRAF 突變癌癥患者、NSCLC 患者和 KRAS 突變型子宮內膜癌患者中都展現 出抗腫瘤活性。
5.HER2:高表達于多種惡性腫瘤中,在研熱門靶點
HER2 蛋白過度表達在多種惡性腫瘤,包括乳腺癌、CA、膽囊癌、卵巢癌、CRC 等,其中約 15%-30%的乳腺癌及 7%-34%的 CA 腫瘤會出現 HER2 蛋白過度表 達,加速癌細胞的侵襲性擴散。
乳腺癌:乳腺癌女性最常見的惡性腫瘤之一,2020 年絕經期前后的婦女發病率較 高,僅 1-2%的乳腺患者是男性,現已知的乳腺癌易感基因包括 BRCA-1/2、 HER2、P53、PTEN 等,除 HER2 陽性率較高外,三陰乳腺癌的 TROP2 突變頻 率超 90%。
2020CSCO 推薦(I 級)靶向 HER2 的抗體藥物作為 HER2 陽性晚期晚期乳腺癌首 要治療方法,曲妥珠單抗治療失敗后可使用吡咯替尼或阿帕替尼聯合化療療法。 根據弗若斯特沙利文報告,2019 年我國 HER2 陽性乳腺癌患者約 8.58 萬,預計 到 2024 年中國 HER2 陽性乳腺癌患者人數將達到 9.25 萬,隨后患者人數將以 1.0%的年復合增長率持續增長,并于 2030 年達到 9.81 萬。
CA:CA 是我國最常見的惡性腫瘤之一,40-60歲多發,男女比例約為 2:1,未 經治療 CA 患者平均壽命約 13 個月,對無法切除的晚期或轉移性 CA 以及術后復 發患者采用細胞毒藥物進行傳統化療的中位生存期僅約11 個月,我國轉移性CA 患者的五年生存率約為 35.1%。CA 常見突變基因為 HER2、PIK3CA、EGFR、 KRAS,其中 HER2 擴增突變為 16%、熱點突變為 3%,我國針對 CA 的靶向藥 物研究眾多,進入臨床的僅限 HER2 抑制劑的一線治療和抗 VEGFR 通路的二/ 三線治療以及 PD-1 聯合用藥等(僅約 20%的轉移性 CA患者可能受益于曲妥珠單抗聯合化療)。
5.1 大分子:曲妥珠單抗類似物競爭激烈,羅氏全系列覆蓋
國內獲批的 HER2 大分子靶向藥包括羅氏的曲妥珠單抗(類似物已上市)、帕妥珠 單抗、恩美曲妥珠單抗以及三生國健的伊尼妥單抗。2020CSCO 乳腺癌診療指南 中推薦曲妥珠單抗+帕妥珠單抗+化療為 HER2 陽性乳腺癌術前治療、早期術后 輔助、晚期復發轉移的一線治療方案(I 級推薦)以及晚期轉移性 CA 一線治療方案 (I 級推薦),2020 版 NCCN 指南推薦曲妥珠單抗+ 帕妥珠單抗或曲妥珠單抗+ 拉帕替尼在 HER2 擴增的晚期 CRC 三線治療。
羅氏曲妥珠單抗是首個以 HER2 為靶點的人源化抗體藥物,1998 年 9 月獲 FDA 批準,2002 年 9 月進入我國。2018 年 2 月羅氏的帕妥珠單抗在國內獲批上市, 在探討曲妥珠單抗+帕妥珠單抗+化療針對轉移性 HER2 陽性乳腺癌一線治療的 試驗中(CLEOPATRA 研究),mPFS 為 18.7 個月,對照組(曲妥珠單抗+化療)為 12.4 個月。
HER2 陽性乳腺癌整體預后較差,使用曲妥珠單抗 10 年后仍有 25%HER2 陽性 早期乳腺癌患者會復發轉移,新輔助治療使用曲妥珠單抗+帕妥珠單抗雙靶治療 后,仍有約 40-60%的患者未達到 pCR(病理完全緩解),其 5 年內復發風險高于 pCR 的患者,少數風險甚至接近 80%。2020 年 1 月,羅氏抗體藥物偶聯物恩美 曲妥珠單抗國內獲批上市,至此羅氏已建立針對 HER2 陽性乳腺癌從最初的新輔 助治療、術后的輔助治療、以及晚期一線治療全程的抗 HER2 治療體系。
1)曲妥珠單抗:2017 年 7 月曲妥珠單抗納入醫保,談判價格為 7600 元/440mg, 降幅達 67%,2019 年醫保談判降價續約,治療方案為每 3 周一次 6mg/kg(首次 劑量 8mg/kg),假設患者平均體重在 60Kg,對于乳腺癌患者年用藥金額約 10 萬 元,CA 患者平均治療費用約 6.5 萬元,2019 年,曲妥珠單抗在城市公立醫院銷 售規模達 52.22 億元,同比增長 38.22%;
2)帕妥珠單抗:推薦起始劑量為 840 mg,此后每 3 周給藥一次,給藥劑量為 420 mg,直至出現疾病進展或不可耐受的毒性,2019 年 12 月江蘇中標價為 18800 元/14ml:420mg,年用藥金額約為 34 萬元,2019 年醫保談判后進一步 降價,2020 年上半年帕妥珠單抗在城市公立醫院銷售規模達 56,747 萬元,相 比于 2019 年全年的 5714 萬元爆發式增長。
3)恩美曲妥珠:最新已公布中標價為 27633 元/160mg,19282 元/100mg,推薦 劑量為 3.6 mg/kg,每 3 周一次(21 天為一個周期)。2020 年上半年恩美曲妥 珠單抗在城市公立醫院銷售規模達 373 萬元。
2020 年 6 月 19 日,我國首個自主研發的創新抗 HER2 單抗藥物——三生國健伊 尼妥單抗獲批上市,適用于與長春瑞濱聯合治療已接受過 1 個或多個化療方案的 HER2 陽性轉移性乳腺癌患者,與曲妥珠單抗相比,伊尼妥單抗具有相同的 2 個 Fab 段,各 214 個氨基酸,但是對 Fc 段進行了氨基酸修飾,同時進行了生產工 藝優化,經 Fc 段修飾后的伊尼妥單抗 ADCC 效應比曲妥珠單抗提高大約 11.1%, 在伊尼妥單抗同步/序貫聯合長春瑞濱治療 HER2 陽性轉移性乳腺癌的 III 期研 究中使患者的無進展生存期顯著延長,進展風險顯著降低。伊尼妥單抗 50mg/支 的零售價為 1530 元/支,用于治療 HER2 陽性轉移性乳腺癌推薦劑量為首次劑 量 8mg/kg,后續 6mg/kg,目前援助方案為 3+3,至無進展生存期用藥金額約為 15 萬。
我國HER2單抗類在研藥物方面,除復宏漢霖的曲妥珠單抗類似物已獲批上市, 嘉和生物藥業、安科生物、齊魯制藥、浙江海正、正大天晴、華蘭生物、上海所 等多家企業處于臨床三期,羅氏的曲妥珠單抗/帕妥珠單抗雙抗藥物也處于 III 期 臨床,復宏漢霖、恒瑞醫藥的帕妥珠已開展臨床 I 期試驗。(雙抗類藥物詳見章節 9)
5.2 小分子:吡咯替尼療效優于拉帕替尼,適應癥快速拓展中
國內獲批的 HER2 類小分子靶向藥包括拉帕替尼、奈拉替尼、吡咯替尼,2007 年 3 月 GSK 的拉帕替尼獲 FDA 批準上市,2013 年 1 月國內上市,顯著延長乳 腺癌患者的無進展生存期,2018 年 8 月恒瑞醫藥吡咯替尼獲批上市。
在恒瑞醫藥的吡咯替尼與拉帕替尼的對照實驗中,無論患者是否接受過曲妥珠單 抗治療,吡咯替尼組均顯示出較優的臨床效益,此外吡咯替尼用于治療 NSCLC,HER2陽性(和早期)乳腺癌的試驗已進行到臨床III期,用于HER2陽性 晚期/轉移性 NSCLC 試驗處于 II 期臨床,2020 年 9 月,江蘇恒瑞醫藥與韓國 HLB-LS 公司達成協議,HLB-LS 將獲得吡咯替尼在韓國的獨家臨床開發、注冊 和市場銷售的權利以及生產選擇權(不含原料藥生產權利)。
吡咯替尼于2018年上市,2019年醫保談判后價格降至254.29元/80mg、355.71 元/160mg,推薦劑量為 400mg/日,21 天為一個周期,一個周期費用約為 2 萬 元,治療用藥應持續直到疾病進展或出現不能耐受的毒性反應,在患者援助項目 下(160mg:8+8;80mg:30+30),吡咯替尼年治療費用約為 16-22 萬元。2019 年吡咯替尼在城市公立醫院銷售規模為 5.38 億元,2020 年上半年為 4.35 億元, 持續放量中。
目前國內 HER2 小分子靶向藥物潛在在研較少,在 HER2 陽性晚期/轉移性乳腺 癌方面進度較快的有齊魯制藥的賽拉替尼,處于 II 期臨床。
6.Parp 抑制劑:BRCA 突變下的有效治療機制
約 10%-15%的卵巢癌患者與遺傳性 BRCA 突變相關,卵巢癌早期無癥狀,超 60%的卵巢癌患者在確診時已為晚期,2 年復發率 75%,5 年生存率不到 40%, PARP 抑制劑可有效延緩卵巢癌的復發時間,提升患者的總生存期。
PARP 抑制劑是一種靶向聚 ADP 核糖聚合酶的癌癥療法,通過與 PARP1/2 催化 位點結合導致 PARP 蛋白無法從 DNA 損傷位點上脫落進而導致 DNA 復制叉停 滯,需激發包括 BRCA1/2 等“類 BRCA”蛋白的同源重復修復功能(HRR)進行修 復,當類 BRCA 蛋白受損會導致 HRR 功能失常進而引發導致細胞死亡從而殺滅 腫瘤細胞,具有 BRCA 突變的腫瘤細胞對 PARP 抑制劑敏感度是攜帶野生型 BRCA 基因的腫瘤細胞的 1000 倍。
目前全球共有 5 款 PARP 抑制劑獲批上市,分別為奧拉帕利(阿斯利康,2014 年)、 蘆卡帕利(Clovis Oncology,2016 年)、尼拉帕利(Tesaro/再鼎醫藥,2017 年/2019 年)、他拉唑帕利(輝瑞,2018 年)以及氟唑帕利(恒瑞醫藥/豪森,2020 年),其中 奧拉帕利、尼拉帕利、氟唑帕利已在我國上市。
1)阿斯利康的奧拉帕利于 2014 年 12 月獲 FDA 批準,為全球首個獲批的 PARP 抑制劑,適應癥已擴大至乳腺癌、卵巢癌、輸卵管癌、腹膜癌、胰腺癌等, 2018 年全球銷售額達到 6.47 億美元,2018 年 8 月奧拉帕利國內上市,用于卵巢 癌靶向治療。在一項針對接受過兩次或以上鉑治療后的 PSR 卵巢癌癥患者中, 奧拉帕利對 BRCA1/2 突變卵巢癌患者中獲益最大,在 BRCA1/2 野生型患者中 獲益不明顯。
2)2016 年 12 月 FDA 批準蘆卡帕利上市,用于單藥治療既往接受過兩種以上化 療的BRCA 突變晚期卵巢癌,在一項針對接受 2種及以上鉑類化療后復發的帶有 BRCA 突變的晚期卵巢癌患者的 II 期試驗中,ORR 為 53.8%,CR、PR 分貝為 9.4%、45.3%,中位 DOR 為 9.2 個月,對鉑化療藥敏感、耐藥、無效的患者 ORR 分別為 65.8%、25.0%、0%。
3)2017 年 3 月,TESARO 的尼拉帕尼獲 FDA 批準上市,用于鉑敏感的復發性 上皮性卵巢癌在含鉑化療達到 CR/PR 后的維持治療(無論是否 BRCA 突變),隨 后拓展至輸卵管癌或原發性腹膜癌的維持治療。2016 年再鼎醫藥獲得尼拉帕利在 中國大陸、香港和澳門開發和推廣的獨家許可,2018年10月在香港獲批,2019 年 12 月獲國家藥監局批準, 2020 年 12 月納入國家醫保,用于鉑敏感的復發性 上皮性卵巢癌、輸卵管癌或原發性腹膜癌成人患者在含鉑化療達到 CR/PR 的維 持治療。
4)2018 年 10 月 FDA 批準輝瑞的他拉唑帕尼上市,用于 BRCA 突變、HER2 陰性的局部晚期或轉移性乳腺癌患者,在 III 期臨床試驗中,實驗組的 Mpfs、ORR顯著優于對照化療組(8.6vs5.6,62.6%vs27.2%)。
5)2020 年 12 月,恒瑞醫藥和豪森開發的氟唑帕利通過優先審評審批程序上市, 用于既往經過二線及以上化療的伴有胚系 BRCA 突變(gBRCAm)的鉑敏感復發性 卵巢癌、輸卵管癌或原發性腹膜癌患者的治療,其獨特的藥理結構優化設計使其 在人體內不易代謝從而保持長期穩定性,因此具備最優的 PARP 抑制劑潛力,氟唑帕利治療卵巢癌患者的有效率高達 69.9%,可延長患者的無進展生存長達 12 個月,是國內目前唯一一個以 Ib 期研究獲批的抗腫瘤藥物。2021 年 1 月,本品 用于鉑敏感的復發性上皮性卵巢癌、輸卵管癌或原發性腹膜癌在含鉑化療 CR/PR 后的維持治療已被國家藥品監督管理局藥品審評中心納入優先審評,氟唑帕利的 多適應癥拓展也在進行中。
奧拉帕利 2019 年納入醫保談判,價格為 442.68 元;尼拉帕利納入 2020 年醫保 談判,由于其生物利用度高(73%)且在人體半衰期長(36h),只需日服一次,且卵 巢癌患者不需 BRCA 基因檢測,依從性、便利性更高,2020 年上半年銷售規模 為 1599 萬元。
目前,國內百濟神州針對 PARP 的 Pamiparib(帕米帕利)進度最快,處于上市申 報階段,該藥用于治療既往接受過至少兩線化療、攜有致病或疑似致病的胚系 BRCA 突變的晚期卵巢癌、輸卵管癌或原發性腹膜癌患者,臨床前模型顯示其 具有穿透血腦屏障和 PARP-DNA 復合物捕捉等藥理學特性。
7.VEGF:貝伐珠單抗類似物競爭激烈,面臨集采壓力
血管內皮生長因子(VEGF)是一種高度特異性的促血管內皮細胞生長因子,具有 促進血管通透性增加、細胞外基質變性、血管內皮細胞遷移、增殖和血管形成等 作用,包括 VEGF-A/B/C/D 和胎盤生長因子(PGF),為實體腫瘤提供氧和營養供 給并作為侵襲和轉移的途徑,與 VEGF 特異性結合的高親和力受體稱為血管內皮 生長因子受體(VEGFR),包括 1/2/3 三類,VEGFR-1/2 主要分布在腫瘤血管內皮 表面,調節腫瘤血管的生成,VEGFR-3 主要分布在淋巴內皮表面,調節腫瘤淋 巴管的生成,目前針對 VEFG 的藥物分為 VEGF 配體和 VEGFR 類藥物兩類。
目前針對VEFG配體的藥物包括貝伐單抗、雷珠單抗、康柏西普、阿柏西普等, 其中雷珠單抗、康柏西普、阿柏西普主要用于眼底疾病。
羅氏貝伐珠單抗于 2004 年 2 月獲 FDA 批準上市,2010 年 2 月在我國上市,聯 合化療用于轉移性 CRC、一線治療不可切除的晚期/轉移性/復發性 NSCLC 以及 膠質母細胞瘤,具有顯著的臨床療效。
貝伐珠單抗及其類似物競爭已呈現白熱化,其在我國的抗體序列專利于 2018 年失效,齊魯制藥、信達生物的貝伐珠單抗類似物相繼獲批,此外東曜藥業、貝達 藥業、山東綠葉制藥、復宏漢霖、蘇州盛迪亞、百奧泰六家公司的貝伐珠單抗生 物類似藥已遞交上市申請,正大天晴、華蘭基因、嘉和生物、上海所、奧賽康、 神州細胞等十家企業處于 III 期臨床,首攻適應癥為 NSCLC、CRC、HC 等大癌 癥,競爭激烈,面臨集采壓力。
2017 年羅氏貝伐珠單抗產品被納入醫保乙類,價格由 5253 元將至 1998 元 (100mg/瓶),2019 年醫保談判續約,據最新公開羅氏中標價為 1934.26 元/100mg,齊魯制藥的貝伐珠單抗注射液在多省份的中標價格為 1198 元 /100mg,信達生物為 1188 元/100mg。貝伐珠單抗用于治療轉移性 CRC 推薦聯 合化療,推薦 5mg/kg/q2w,用于晚期/轉移性/復發 NSCLC,推薦劑量 15mg/kg/q3w。2020 上半年,貝伐珠單抗銷售規模為 17.17 億元,同比增長 20.90%,其中齊魯制藥銷售規模為 3.52 億元,占據 20.49%的市場。
應用于腫瘤領域的VEGF類靶向藥物除貝伐珠單抗類似物外,進度最快的為阿斯 利康的凡他尼布,適用于晚期/轉移性甲狀腺癌的試驗處于 III 期臨床,中山康方 靶向 VEGF 和 PD-1 的雙抗類藥物 AK112 處于 II 期臨床階段
8.VEGFR:多靶點抑制劑,多點開花
8.1 概覽
國內上市的針對 VEFGR 的靶向藥物包括帕唑帕尼、索拉非尼、舒尼替尼、凡德 他尼、阿昔替尼等。
除以上已獲批上市的VEFG類靶向藥外,江蘇豪森藥業的卡博替尼、再鼎醫藥的 瑞普替尼、澤璟生物的多納非尼以及禮來的雷莫蘆單抗均處于上市申請中,再鼎 醫藥(上海)用于 HCC 的布立尼布處于 III 期臨床,百濟神州、長春金賽藥業、成 都康弘等適用于晚期/轉移性 CA、胃食管交界處癌等癌種的新藥處于 II 期臨床, 逐步步入收獲期。
8.2 阿帕替尼:獲批于三線 CA,多種適應癥拓展進行中
2014 年 12 月,恒瑞醫藥主要靶向 VEGFR-2 的阿帕替尼片獲批上市,用于治療 既往至少接受過2種系統化療后進展或復發的晚期胃腺癌或胃食管結合部腺癌患 者,是全球第一個在晚期 CA 被證實安全有效的小分子抗血管生成靶向藥物,降 低晚期 CA 患者(3L)30%的死亡風險,同靶點的雷莫蘆單抗(禮來)正處于國內上市 申請階段,具體療效還需要頭對頭試驗進一步驗證。2021 年 1 月 8 日,阿帕替 尼獲批準用于晚期 HCC二線用藥,針對無法/不愿意手術的中晚期HC 患者(II期) 臨床試驗結果可與索拉非尼 II 期結果媲美(兩者 mTTP 基本相同),阿帕替尼 mOS 具有一定的優勢。
阿帕替尼納入 2017 年醫保目錄,價格為 136 元/120mg,2019 年醫保談判續 談,最新中標價為 115 元/250mg,臨床推薦劑量為 850mg/日,用藥費用約為 3萬元。2020 上半年阿帕替尼銷售規模為 10.19 億元,同比增長 6.23%。
恒瑞醫藥正在進行有關阿帕替尼單藥或者聯合用藥的多項適應癥拓展,其中 CA、HC、胰腺癌、卵巢癌、乳腺癌、復發的上皮性卵巢癌、輸卵管癌及原發性 腹膜癌等龐大的候選適應癥處于臨床III期,具有龐大的想象空間。2019年CSCO 公布了阿帕替尼在 CA、肺癌等領域的研究成果,在 CA 領域,卡瑞利珠單抗聯 合 CAPOX 方案研究初顯成效,ORR 達 58.7%,DCR 達 78.3%,且安全性良 好;在肺癌領域,阿帕替尼單藥治療廣泛期 SCLC,ORR 達 19.35%,DCR 達 83.87%、PFS 達 6.18m,為廣泛期的患者二線治療提供了新選擇,
8.3 呋喹替尼:mCRC3L 療法,2020 銷售規模約 2.2 億
呋喹替尼于 2018 年 9 月國內批準上市,作用靶點為 VEGFR1/2/3,適用于既往 接受過氟尿嘧啶類、奧沙利鉑和伊立替康為基礎的化療,以及既往接受過或不適 合接受抗 VEGF、EGFR 治療(RAS 野生型)的轉移性結直腸癌(mCRC)患者(3L)。 目前呋喹替尼適用于晚期/轉移性 CA、晚期/轉移性胃食管交界處癌、非鱗狀 NSCLC 的臨床試驗均處于 III 期臨床,獲批后加速品類放量。
呋喹替尼 2019 年醫保談判成功,價格降至 378 元/5mg、94.5 元/1mg,推薦劑 量為 5mg/日,服藥 3 周停藥 1 周(4 周為一個治療周期),據和黃醫藥業績公告顯 示,2020 年呋喹替尼銷售規模約為 2.2 億,相同比增長 91%。8.4 安羅替尼:填補國內肺癌患者兩種系統化療后無標準 治療市場
正大天晴多靶點藥物安羅替尼 2018 年 5 月國內獲批上市,可作用于 VEGFR2/3、FGFR1-4、PDGFR α/β、c-Kit、Ret 等多靶點,適用于不可切除的 局部晚期/轉移性甲狀腺髓樣癌、SCLC(3L)、NSCLC(3L,EGFR-TKI/ALK-TKI 和至少兩種化療)、腺泡狀軟組織肉瘤、透明細胞肉瘤以及既往至少接受過含蒽環 類治療后進展或復發的其他晚期軟組織肉瘤患者,填補了接受過兩種系統化療 后無標準治療的市場,其在局部晚期/轉移性 NSCLCIII 期臨床試驗中,安羅替尼 組 mOS 顯著延長(9.46 月)。
安羅替尼納入 2018 年醫保談判,2020 年續談成功,價格為 306.88 元/12mg, 推薦劑量為每日 1 次 12 mg,服藥 2 周停 1 周(一療程)直至疾病進展或出現不可 耐受的不良反應。2019 年安羅替尼銷售超 20 億元,2020 年上半年為 12.26 億 元,同比增長 55.46%。
此外,安羅替尼用于晚期/轉移性 RCC,胃食管交界處癌,鱗狀 NSCLC,胃腺 癌,晚期/轉移性 SCLC,晚期/轉移性 HCC 等多種癌癥臨床試驗正在開展當中。
8.5 神經內分泌瘤:索凡替尼率填補國內 nPnet 治療, Pnet 適應癥審批中
神經內分泌瘤(Net)通常分為胰腺 Net(Pnet)和非 Pnet(nPnet),其中 Pnet 約占新 發病例的 1%-3%,60%-70%的 Pnet 患者確診時已經發生了轉移,早期診斷率低。據 Frost & Sullivan 估計,2018 年美國 Net 新發病例 1.9 萬例,我國約新發 6.76 萬例,按我國發病率與流行率比例估算,共有約 30 萬例 Net 患者,其中約 80%為 Npnen,目前國內獲批的靶向藥物有舒尼替尼、索凡替尼、依維莫司。
2020 年 12 月和黃醫藥的索凡替尼膠囊獲批上市,用于治療晚期 nPnet,這是和 黃醫藥于我國獲批的第二款腫瘤藥物。索凡替尼可通過 VEGFR 和 FGFR 阻斷腫 瘤血管生成,并可抑制集落刺激因子-1 受體(CSF-1R)調節腫瘤相關巨噬細胞, 具有抗血管生成和免疫調節雙重活性,2020 年 9 月用于治療晚期 Pnet 的新藥上 市申請已獲受理,2020年12月已向FDA滾動提交用于治療胰腺和nPnet(NETs) 的新藥上市申請的第一部分,計劃于 2021 年上半年完成新藥上市申請提,此 外和黃醫藥已經與君實生物、百濟神州、信達生物等中國創新藥企的腫瘤免疫 PD-1 抗體開展聯合用藥研究,以期擴大索凡替尼的適應證。2020 年 1 月 16 日,索凡替尼完成河南首單銷售,價格為 101 元/50mg,推薦劑 量為每日一次 300mg(6 粒),連續服藥(4 周為一個治療周期),一個療程價格為 1.69 萬元,低保患者可獲得最多 12 周期的治療援助,且對于非低保患者有援助 計劃(2周期+2周期),PNEN、nPNEN患者年用藥費用分別約為 10、7萬元,其 上市后兩個月取得未審計的銷售收入約 3191 萬元,如果納入醫保將有助于快速 放量。
8.6 肝癌:我國肝癌 mOS 僅約 1 年,亟需突破性新藥
我國肝癌(HC)高發,預后差,五年生存率低于 15%。HC 是我國特有的高發癌種,2019 年新發病例數達 36.94 萬例,約占全球 HC 病例的 47.5%,中華預防醫學 會統計,其新發病例數在過去 20 年中增長了 2 倍,80%以上患者有乙肝感染病 史,我國現有近 1 億的乙肝病毒攜帶者。目前我國治療早期 HC 的方法有切除手 術、放療、消融、放射免疫療法等,晚期 HCC 治療方法主要包括小分子靶向療 法、檢查點抑制劑及化療,57%患者首診已是晚期或終末期,僅可以從化療與分 子靶向藥療法中獲益,且由于 HCC 對化療相對不敏感,因此靶向藥意義重大。
2020CSCO 指南中,對于晚期 HC 患者但肝功能稍好的患者,I 級推薦索拉非尼、 侖伐替尼、多納非尼等靶向藥物治療。
1)索拉非尼:在針對晚期 HC 患者的 III 期臨床試驗中,索拉非尼組的 mOS 為 10.7 個月,比未接受治療的患者多 2.8 個月。
2)侖伐替尼:在與索拉非尼針對晚期 HCC 患者的頭對頭Ⅲ期臨床研究中,侖伐 替尼組 mOS 較索拉非尼組有延長趨勢(13.6vs.12.3);在 mPFS、mTTP、ORR 均顯著改善,中國患者侖伐替尼組數據更佳,2018 年歐洲 EMEA、美國 FDA 和 中國 NMPA 已相繼批準了侖伐替尼一線治療不可切除 HCC 的適應證。
3)瑞戈非尼(拜萬戈):2017 年 4 月、12 月分別被 FDA 和 NMPA 批準用于索 拉非尼治療失敗的晚期 HCC 二線治療,作為晚期 HCC 患者的二線治療依然能 帶來明顯的生存獲益,目前瑞戈非尼已經進入醫保,價格為 5488 元每盒(7 天)。
4)多納非尼:澤璟制藥的多納非尼是索拉非尼分子上的一個甲基取代為三氘代 甲基而形成的全新的專利藥物,與索拉非尼相比明顯具有更優異的藥代動力學和 藥效學性能。在針對不可手術或轉移性HCC 患者II/ III臨床床試驗中,多納非尼 組與索拉非尼組的 mOS 為 12.1、10.3 月,mPFS 為 3.7、3.6 月,ORR 為 4.6%、2.7%,且多納非尼組各級不良反應均顯著低于索拉非尼組,目前多納非 尼已國家藥監局藥審中心納入擬優先審評審批品種公示名單。
2008 年索拉非尼在我國獲批上市,2017 年納入醫保談判,2019 年續談,2020 年上半年銷售規模為 6.34 億元,目前索拉非尼(200mg)已被納入第四批集采,重 慶藥友(26.6 元)、山香藥業(24.48 元)中標,價格降幅均超 70%;瑞戈非尼納入 2018 年醫保,2020 年續談,2020 年 9 月最新可見中標為 196 元/40mg,療效優 于索拉非尼,2020 年上半年銷售規模為 3.22 億元,同比增長 104.90%;侖伐替 尼納入 2020 年醫保談判,2020 上半年銷售規模為 1.56 億元,同比增長 73.75%。
我國治療 HC 的方法療效有限,中位無進展生存期不足 10 個月,中位總生存期 僅約一年,亟需更有效的新型的治療方案。據弗若斯特沙利文數據,2018 年我國 晚期 HCC 一線小分子靶向藥市場為 8.1 億元,可惠及人口滲透率為 4.6%,美國 為 23.3%,據 Frost & Sullivan 數據,隨著市場教育推進、患者支付能力提高、 醫保對接、新藥上市等,預計我國 2030 年滲透率將提升至 43.2%,整體市場規 模將達到 160 億元。(不考慮索拉非尼納入集采導致降價與滲透率提升相互作用, 預計將導致晚期 HC 一線靶向藥物存量市場降低 10%左右)。
8.7 腎癌:一二線靶向藥均已醫保談判成功
2020CSCO 推薦對于轉移性或不可切除性透明細胞型 RCC,一線推薦舒尼替 尼、培唑帕尼、索拉非尼等小分子靶向藥物,阿昔替尼可用于 TKI 失敗后的二線 療法,此外帕博利珠單抗適用于一線高危 RCC 以及二線治療。
全球已批準了十幾藥物用于轉移性 RC 的治療,包括抗 VEGF/VEGFR 途徑(索 拉非尼、舒尼替尼、培唑帕尼、阿昔替尼、貝伐珠單抗、卡博替尼、侖伐替 尼)、抑制 mTOR 途徑(依維莫司和替西羅莫司)和免疫檢查點抑制劑(納武利尤單 抗、納武利尤單抗+伊匹木單抗、帕博利珠單抗+阿昔替尼),目前我國批準上市的 用于轉移性 RC 的靶向藥物包括索拉非尼、舒尼替尼、培唑帕尼、依維莫司和阿 昔替尼。
舒尼替尼、培唑帕尼、阿昔替尼均于2018年醫保談判成功,2020年續談,其中 舒尼替尼 2020 年直接納入乙類醫保。2020 上半年舒尼替尼銷售規模為 2.15 億 元,同比增長 37.08%,輝瑞 2020 年中標價為 155 元/12.5mg,用于胃腸間質瘤 和晚期 RCC 的推薦劑量是 50 mg,每日一次,服藥 4 周停 2 周,對于 Pnet,37.5 mg/日/次,目前已有石藥歐意和豪森藥業獲批上市,石藥歐意最新中標價 格為 107 元/12.5mg,仿制藥的上市有助于用藥滲透率的提高;培唑帕尼 2020 年續談價格為 160 元/200mg,272 元/400mg,2020 上半年銷售規模為 1.64 億 元,同比增長 186.11%;阿昔替尼最新中標價為 207 元/5mg,2020 上半年銷售 規模為 1.12 億元,同比增長 208.68%。
9.ADCs:在研管線以靶向 HER2 為主,行業熱情高漲,潛在空間廣闊
抗體藥物偶聯物(ADC)是通過化學鏈接將具有生物活性的小分子藥物連接到單抗 上,單抗作為載體將小分子藥物靶向運輸到目標細胞中,旨在靶向殺死腫瘤細胞 的同時使健康細胞免遭傷害。通過抗體和靶蛋白(抗原)之間的生化反應觸發了腫 瘤細胞內的信號后腫瘤細胞吸收或內化抗體及所連接的細胞毒素,細胞毒素進入 腫瘤細胞后釋放并殺死癌癥。ADC 藥物包括抗體、連接子、細胞毒素三部分, 靶向在腫瘤細胞特異性表達或高表達抗原的抗體、穩定性又可在特定部位釋放 的連接子、高毒性活性和低免疫的細胞毒素的選擇是 ADC 藥物有效且穩定低毒 的關鍵。
目前ADC藥物已進展至第三代,第三代ADC可實現定向偶聯,產生藥物抗體比 (DAR)均一的 ADC,一般每個抗體上結合 2-4 個毒性化合物的治療窗最大,過低 則抗體攜帶效率較低,過高機體易將其識別為異物從而快速清除,同時 ADC 藥 物為不同 DAR 的混合物,不同 DAR 的異質性將導致毒性的不確定,甚至存在未 結合值的細胞毒藥物,造成脫靶毒性。第三代 ADC 藥物利用小分子藥物與單抗 的位點實現特定位置偶聯,降低藥物毒性,減少未結合的抗體,提高藥物的穩定 性和藥代動力學效率。目前定點偶聯技術主要應用的技術有 Thiomab 技術、引 入非天然氨基酸、半胱氨酸突變、硒代半胱氨酸、酶催化法等。 截止 2020 年底,FDA 已批準 10 個 ADC 藥物上市,2019 年來獲批加速(6 個), 其中武田靶向 CD30 的維布妥昔單抗(Adcetris)和羅氏靶向 HER2 的恩美曲妥珠 單抗(Kadcyla)表現亮眼,2019 年銷售額分別為 10.81、15.72 億美元。
目前不可切割 linker(如 MCC、MC)的 ADCS 多在血液腫瘤上療效顯著,對于可 裂解 linker,細胞毒素切割后可以穿透細胞膜進入旁邊癌細胞,發揮旁觀者殺傷 效應,可更好的作用于實體瘤,也是目前研發的熱點。
我國已獲批上市了兩款 ADC 藥物,武田的維布妥昔單抗和羅氏的恩美曲妥珠單抗分別于 2020 年 5 月、1 月在我國獲批上市,1)恩美曲妥珠單抗獲批用于受了 紫杉烷類聯合曲妥珠單抗為基礎的新輔助治療后仍殘存侵襲性病灶的HER2陽性 早期乳腺癌患者的輔助治療,恩美曲妥珠單抗是將曲妥珠單抗與抑制微管聚集的 化療藥物美登素通過硫醚連接子連接成的穩定的抗體偶聯藥物,適用于接受了紫 杉烷類聯合曲妥珠單抗為基礎的新輔助治療后仍殘存侵襲性病灶的HER2 陽性早 期乳腺癌患者的輔助治療,KATHERINE 研究顯示,恩美曲妥珠單抗組患者輔助 治療后 3 年內,無侵襲性癌生存率(iDFS)達到 88.3%,曲妥珠單抗單藥組為 77%,復發或死亡風險降低 50%,填補了我國新輔助治療后 non-pCR HER2 陽 性乳腺癌患者的治療空白;2)維布妥昔單抗獲批用于治療復發性或難治性系統性 間變性大細胞淋巴瘤(sALCL)或 CD30 陽性霍奇金淋巴瘤患者。
除已獲批上市的兩款進口 ADC 藥物外,進展最快的國產 ADC 為榮昌生物靶向 HER2 的緯迪西妥單抗,處于上市申請中,用于三線治療局部晚期或轉移性胃癌 (CA)(包括胃食管結合部腺癌),截至 2020 年 6 月 22 日,在針對 127 名曾接受過 二線化療治療的 HER2 過表達(IHC 2+或IHC 3+)CA或 GEJ 癌癥患者的II期注 冊性臨床試驗中,ORR 為 24.4%,mPFS 為 4.1 個月,mOS 為 7.6 個月,此 外 FDA 于 2020 年 9 月已授予緯迪西妥單抗突破性療法認定,適應癥為 HER2 表達的(IHC 2+或 IHC 3+)局部晚期或轉移性尿路上皮癌二線治療,公司計劃 2021 年在美國啟動緯迪西妥單抗治療 CA 和尿路上皮癌患者的臨床研究。
我國目前在研 ADC 藥物的靶點較為集中,處于臨床階段的藥物主要涉及靶點為 HER2,其他靶點包括 c-Met、EGFR、Trop 2、CD 20,其中浙江醫藥與 Ambrx 聯合開發靶向 HER2 的 ADC 藥物 ARX788 處于 III 期臨床,擬用于 HER2 陽性乳 腺癌,利用非天然氨基酸插入蛋白質,pAF 通過肟鍵偶聯毒素 AS269,實現毒 素在單抗分子上的精確偶聯,DAR 為 2(恩美曲妥珠單抗偶聯率覆蓋 0-8,平均 DAR 為 3.5),且肟鍵極其穩定,體內代謝產物僅有 pAF-AS269,而無游離毒素AS269,療效穩定、安全性好。 在針對 51 例至少一次 ARX788 的中國女性患者 實驗中,最佳響應為部分緩解(PR)19 例,穩定(SD)為 25 例,疾病控制率為 91.7%(44/48),療效隨劑量增加而提高,其中 1.3mg/kg 劑量組總緩解率(ORR) 達到 56% (9/16),后續 實驗中 隨著劑 量遞增 ORR 提 升, 1.5mg/kg 組 ORR68.4%,DCR100%,無 DLT 發生,既往經 TKI 治療患者 ORR 為 44.7%, 潛力巨大。
百奧泰兩款 ADC 藥物 BAT8001、BAT8003 處于臨床 III 期、I 期,分別靶向 HER2、TROP2,其中 BAT8001 為第二代 ADC 藥物,BAT8003 為采用定點偶 聯技術的三代 ADC 藥物,此外 BAT8003 采用不可剪切式連接子保證了體內循 環安全性,體內藥效學顯示 BAT8003 在三陰性乳腺癌和 CA 移植瘤模型中在 5mg/kg 或以上劑量下均能顯著地抑制腫瘤的生長,且安全性良好。
據弗若斯特沙利文分析,預計 2020 年我國用于 HER2 陽性乳腺癌的 ADCs 市場 規模為 260 萬美元,2020-2024 年的復合年增長率為 207.4%,預計 2030 年將 達到 4149 萬美元。
10.重點企業分析(詳見報告原文)
……
風險提示:藥物研發失敗風險,集采降價超預期,賽道踩踏風險,產品推廣不 達預期。
(本文僅供參考,不代表我們的任何投資建議。如需使用相關信息,請參閱報告原文。)
精選報告來源:【未來智庫官網】。

張原
<del id="gyqqi"></del> <del id="gyqqi"></del> <strike id="gyqqi"></strike>
