
科技改變生活 · 科技引領(lǐng)未來(lái)

科技改變生活 · 科技引領(lǐng)未來(lái)
在《銀屑病:減肥和飲食調(diào)整改善病情》我們介紹了如何通過(guò)減肥和調(diào)整飲食改善銀屑病,這一篇繼續(xù)介紹生物制劑和幾種營(yíng)養(yǎng)素的作用。回顧上一篇,我們簡(jiǎn)單介紹了樹(shù)突細(xì)胞,免疫T細(xì)胞,巨噬細(xì)胞、皮膚的角質(zhì)細(xì)胞等,共同參與炎癥的級(jí)聯(lián)反應(yīng)(cascade),
在《銀屑病:減肥和飲食調(diào)整改善病情》我們介紹了如何通過(guò)減肥和調(diào)整飲食改善銀屑病,這一篇繼續(xù)介紹生物制劑和幾種營(yíng)養(yǎng)素的作用。
回顧上一篇,我們簡(jiǎn)單介紹了樹(shù)突細(xì)胞,免疫T細(xì)胞,巨噬細(xì)胞、皮膚的角質(zhì)細(xì)胞等,共同參與炎癥的級(jí)聯(lián)反應(yīng)(cascade),導(dǎo)致細(xì)胞因子包括IL-17A、IL-23、IL-22、TNF-α等的大量分泌,這些細(xì)胞因子都參與到銀屑病的病例機(jī)制。 那究竟為什么這些免疫細(xì)胞會(huì)“無(wú)緣無(wú)故”被喚起? 其中一個(gè)理論,跟所有免疫系統(tǒng)有關(guān)疾病和炎癥一樣,銀屑病很可能跟身體的氧化應(yīng)激有關(guān)。
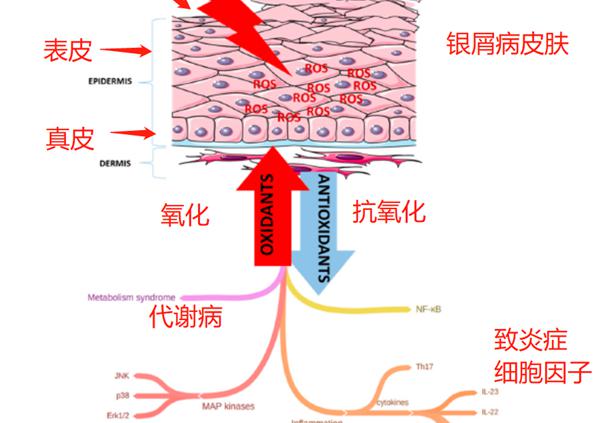
下圖簡(jiǎn)化包括代謝性疾病、MAP激酶信號(hào)等導(dǎo)致的氧化應(yīng)激跟銀屑病的關(guān)系。MAP激酶細(xì)胞信號(hào)可以啟動(dòng)銀屑病的炎癥級(jí)聯(lián)反應(yīng),而身體的氧化應(yīng)激也是MAP激酶被喚起的誘因,當(dāng)身體的氧化應(yīng)激嚴(yán)重,自由基ROS/RNS導(dǎo)致皮膚炎癥,產(chǎn)生大量的致炎癥細(xì)胞因子,直接導(dǎo)致角質(zhì)細(xì)胞的增殖和炎癥的持續(xù)。[46]
臨床上多年來(lái)都有采用外用藥物,包括糖皮質(zhì)醇和維生素D衍生物等治療銀屑病,而最新銀屑病的治療手段是通過(guò)生物制劑,包括上一代的TNF-α抑制劑(etanercept, infliximab, 和adalimumab)和新一代的IL-17A、IL-23、IL-22抑制劑等。
生物制劑治療銀屑病
近年應(yīng)用生物制劑治療銀屑病有不錯(cuò)的突破,由于銀屑病是免疫細(xì)胞跟皮膚角質(zhì)細(xì)胞在不同的致炎癥細(xì)胞因子影響下的炎癥反應(yīng),生物制劑主要有幾個(gè)治療方向:1)抑制TNF-α, 2)抑制IL-17,和3)抑制IL-23。[1]
2020年發(fā)表的雙盲對(duì)照組臨床研究,[2] 使用過(guò)TNF-α抑制劑無(wú)效的銀屑病患者,在使用IL-17A抑制劑,蘇金單抗(300mg)72周后,77%患者的達(dá)到PASI 75的局部康復(fù)標(biāo)準(zhǔn),證明該藥比上一代的靶點(diǎn)在TNF-α生物制劑更為有效。 2020年挪威發(fā)表的研究論文,詳細(xì)比較了IL-17,IL-23,和TNF抑制劑的生物制劑,結(jié)論也是IL-17和IL-23為靶點(diǎn)的生物制劑比TNF-α有效。[1]
2015年被美國(guó)FDA和2019年被中國(guó)藥監(jiān)局批準(zhǔn)作為銀屑病治療的生物制劑蘇金單抗(Secukinumab,商品名“可善挺”)為例,我們從2個(gè)大型的雙盲對(duì)照組臨床研究可以看到其效果。[3] 蘇金單抗是IL-17A致炎癥細(xì)胞因子的抑制劑。ERASURE臨床試驗(yàn)的受試者樣本是738名,而FIXTURE臨床試驗(yàn)的樣本是1306名銀屑病患者,連續(xù)5周每周注射一次(150mg或300mg),之后4周一次持續(xù)約一年,結(jié)果顯示PASI 75,也就是銀屑病改善75%的患者,在第12周ERASURE臨床研究的受試者有81.6%(300mg)和71.6%(150mg),而FIXTURE臨床研究的受試者有77.1%(300mg)和67.0%(150mg),都顯示治療銀屑病的效果顯著。
該藥在2019年也發(fā)表了對(duì)中國(guó)銀屑病中度到重度患者的雙盲對(duì)照組臨床研究的結(jié)果,[4] 441名中國(guó)的銀屑病患者參與試驗(yàn),在接受蘇金單抗治療12周后97.7%(300mg)和82.3%(150mg)的患者改善銀屑病75%(PASI 75指數(shù)),效果持續(xù)到治療結(jié)束的52周后。
日本在2019年發(fā)表的雙盲對(duì)照組臨床研究,[5]跟蹤了接受蘇金單抗治療(300mg)康復(fù)的銀屑病患者3年,發(fā)現(xiàn)在3年內(nèi)復(fù)發(fā)的比例不算高,PASI 90 (改善90%)和PASI 100 (100%改善)的患者在3年后分別為69.2%和53.8%。
除了蘇金單抗之外,同樣以IL-17A為靶點(diǎn)的生物制劑還有ixekizumab和Brodalumab,效果都不錯(cuò)。[6]
也有生物制劑的靶點(diǎn)是IL-23致炎癥細(xì)胞因子,IL-23介導(dǎo)Th17細(xì)胞分泌IL-17致炎癥細(xì)胞因子,所以抑制IL-23同樣可以阻斷銀屑病的炎癥級(jí)聯(lián)反應(yīng)。針對(duì)IL-23的生物制劑是risankizumab(商品名Skyrizi),在2019年被美國(guó)FDA批準(zhǔn)作為治療銀屑病用藥,雙盲對(duì)照組臨床研究發(fā)現(xiàn),Skyrizi使72%-75%的銀屑病患者達(dá)到PASI 90的局部康復(fù),用藥1年后56%-60%達(dá)到PASI 100,也就算是完全康復(fù)。 跟蘇金單抗比較,Skyrizi只需要開(kāi)始在4周內(nèi)注射2次,之后3個(gè)月一次就可以了,頻次更低,對(duì)患者造成的不便可以減少。[7]
生物制劑對(duì)銀屑病患者帶來(lái)希望,但價(jià)格較貴。 有研究統(tǒng)計(jì)過(guò)美國(guó)銀屑病患者使用不同生物制劑達(dá)到基本效果(PASI 75<)的成本,[8] 因?yàn)椴皇且粋€(gè)療程就一定可以達(dá)標(biāo),之后可能還得補(bǔ)幾針,而且不同生物制劑要出效果的劑量和注射次數(shù)不一樣,最低消費(fèi)在6.2萬(wàn)美元以上,只能局部改善(PASI 75),如果要達(dá)到PASI 100,最低消費(fèi)是23萬(wàn)美元。我國(guó)的生物制劑價(jià)格較低,蘇金單抗大概3000元一針,一年15到30針就4.5萬(wàn)到9萬(wàn)人民幣,之前評(píng)論區(qū)有反映此藥進(jìn)醫(yī)保后價(jià)格降到1200一針。(數(shù)字只作為大概的參考,具體到醫(yī)院咨詢)
生物制劑的價(jià)格只是其中一個(gè)局限,由于IL-17A是人體對(duì)抗念珠菌的免疫反應(yīng)的重要細(xì)胞因子,抑制IL-17的生物制劑的其中一個(gè)副作用是增加真菌念珠菌的感染風(fēng)險(xiǎn),所以對(duì)于有IBD炎癥性腸病的患者是不適應(yīng)使用的。[6] 2020年發(fā)表的一項(xiàng)對(duì)使用IL-17A抑制劑的強(qiáng)直性脊柱炎患者和銀屑病患者的研究發(fā)現(xiàn),使用IL-17A生物制劑容易導(dǎo)致腸道炎癥,1L-17A抑制劑改變腸道菌群,增加腸道中的念珠菌。[9] 其實(shí)銀屑癥患者跟炎癥性腸病(IBD)的關(guān)聯(lián)性很高,分析銀屑癥患者和IBD患者的菌群也發(fā)現(xiàn)有不少共通性。 [10] 對(duì)照組隊(duì)列研究發(fā)現(xiàn)銀屑病患者的腸道菌群失衡,菌群的多樣性減少,個(gè)別菌種相對(duì)健康對(duì)照組顯著較高。[11]
把這些連起來(lái),我個(gè)人的猜想是:腸道的真菌過(guò)度生長(zhǎng),可能促使免疫系統(tǒng)增加分泌IL-17家族細(xì)胞因子作為對(duì)真菌感染的免疫反應(yīng),但I(xiàn)L-17同時(shí)導(dǎo)致皮膚的炎癥反應(yīng),結(jié)果可能是銀屑病的病癥,所以抑制IL-17可以緩解銀屑病病情,但也等于需要對(duì)念珠菌感染“投降”,如果真的是這樣的話,處理腸道問(wèn)題特別是腸道真菌過(guò)度生長(zhǎng),可能是治療銀屑病的其中一個(gè)治本路徑。但上述純屬我的個(gè)人猜測(cè),有待日后臨床研究進(jìn)一步的發(fā)現(xiàn)。
TNF-α、IL-17和IL-23都只是銀屑病炎癥中的信使(messengers),治療銀屑病的生物制劑雖然阻斷了銀屑病的炎癥級(jí)聯(lián)反應(yīng),但可能只是“殺死信使”(kill the messenger)的解決辦法而已,因?yàn)椴](méi)有真正治療引起銀屑病的身體氧化應(yīng)激問(wèn)題,不排除銀屑病還會(huì)復(fù)發(fā),也不排除氧化應(yīng)激的結(jié)果出現(xiàn)在銀屑病之外的健康問(wèn)題上,包括其他免疫系統(tǒng)有關(guān)的疾病。2012年一項(xiàng)大型隊(duì)列研究,[12] 包括了2萬(wàn)5千多名銀屑病患者樣本,發(fā)現(xiàn)銀屑病患者患上另外2種或以上的自免疫系統(tǒng)疾病的風(fēng)險(xiǎn)更高,風(fēng)險(xiǎn)增加90%。而同時(shí)患上乳糜瀉的風(fēng)險(xiǎn)是正常人的2.2倍。
無(wú)論是否使用生物制劑,都需要從飲食等更根本的方法入手解決身體氧化應(yīng)激問(wèn)題。
魚(yú)油
1988年在《柳葉刀》發(fā)表的一項(xiàng)雙盲對(duì)照組臨床研究,[13] 28名銀屑病患者接受試驗(yàn),干預(yù)組每天3g的歐米茄魚(yú)油,對(duì)照組使用橄欖油,8周后有干預(yù)組的銀屑病病情顯著改善,包括痕癢較少,銀屑病的皮膚面積減少等。
1990年的一項(xiàng)臨床研究,[14]80名已經(jīng)病情穩(wěn)定的銀屑病患者接受試驗(yàn),當(dāng)中34名同時(shí)患銀屑病性關(guān)節(jié)炎(psoriatic arthritis),受試者連續(xù)8周每天補(bǔ)充1.1g的EPA+0.75g的DHA,結(jié)果在4周后反映銀屑病病情的PASI指數(shù)從平均3.56降低到1.98,然后在試驗(yàn)8周后減低到1.24,7名患者完全康復(fù),13名患者改善75%,大部分銀屑病性關(guān)節(jié)炎患者表示關(guān)節(jié)疼痛減少。
1998年的一項(xiàng)雙盲對(duì)照組臨床研究,[15]83名銀屑病患者接受試驗(yàn),干預(yù)組連續(xù)14天每天通過(guò)輸液補(bǔ)充4.2g的EPA+DHA,結(jié)果PASI指數(shù)減少11.2,一共16名干預(yù)組受試者(37%)的病情改善超過(guò)50%。
另一項(xiàng)類似的雙盲對(duì)照組臨床試驗(yàn),[16] 20名銀屑病患者連續(xù)10天每天通過(guò)輸液補(bǔ)充4.2g的EPA+DHA,免疫細(xì)胞的中性粒細(xì)胞PAF因子在歐米茄3補(bǔ)充后顯著減少,銀屑病病情快速得到緩解。
一項(xiàng)15周的雙盲對(duì)照組研究,[17] 魚(yú)油配合紫外光燈治療銀屑病病,比對(duì)照組的橄欖油配合紫外光燈治療效果更顯著,研究認(rèn)為考慮到魚(yú)油的安全性,是最佳輔助治療銀屑病的手段。另一項(xiàng)對(duì)照組臨床研究,[18] 干預(yù)組使用外用維生素D軟膏(tacalcitol)加上歐米茄3魚(yú)油,對(duì)照組只使用維生素D軟膏,8周后2組受試者的銀屑病病情都顯著改善,但添加了魚(yú)油的干預(yù)組改善更為顯著。臨床研究也顯著使用EPA配合處方藥(etretinate)比單獨(dú)使用處方藥對(duì)改善銀屑病病情更有效。[19]
2019年的一項(xiàng)薈萃分析,[20] 包括了10個(gè)臨床試驗(yàn)一共560名患者樣本,發(fā)現(xiàn)歐米茄3可以顯著降低PASI,降低平均1.58,也顯著減少紅疹和痕癢,劑量高的歐米茄3效果更為明顯。2020年的一項(xiàng)系統(tǒng)性回顧,[21] 包括了18個(gè)臨床研究一共927名患者樣本,發(fā)現(xiàn)歐米茄3魚(yú)油作為輔助治療可以顯著降低PASI指數(shù)平均3.92,但單獨(dú)使用魚(yú)油治療效果并不明顯。歐米茄3魚(yú)油對(duì)改善銀屑病病情的臨床研究也有不少顯示作用不顯著。[22] 歐米茄3中,EPA對(duì)銀屑病的作用明顯,因?yàn)镋PA有較強(qiáng)的緩解炎癥的作用。[23]
不少臨床研究證實(shí)歐米茄3魚(yú)油可以改善銀屑病病情,但也有臨床研究發(fā)現(xiàn)效果不顯著,學(xué)者認(rèn)為可能跟EPA比例和整體魚(yú)油食用劑量低有關(guān)系。[24] 魚(yú)油是極為安全的營(yíng)養(yǎng)素,可以改善多種身體的炎癥有關(guān)疾病,就算研究證據(jù)沒(méi)有達(dá)到一致,都值得嘗試。
維生素D
活性維生素D(1,25(OH)2D)是免疫系統(tǒng)重要的調(diào)節(jié)介質(zhì),可以減少致炎癥細(xì)胞因子包括TNF-a、IL-1、IL-6等。 樹(shù)突細(xì)胞是銀屑病發(fā)病機(jī)制的重要細(xì)胞,維生素D壓制樹(shù)突細(xì)胞的分化、成熟和減少抗原呈遞。 維生素D也壓抑免疫T細(xì)胞的增殖,減少致炎癥細(xì)胞因子IL-17A,IL-22的產(chǎn)生。
關(guān)聯(lián)性研究發(fā)現(xiàn)缺乏維生素D跟銀屑病有較強(qiáng)的關(guān)聯(lián)性,補(bǔ)充維生素D可能對(duì)緩解銀屑病有幫助。[25] 2018年的對(duì)照組研究,[26] 分析了561名銀屑病患者和340名對(duì)照組健康受試者,發(fā)現(xiàn)銀屑病患者的維生素D水平(21.8ng/ml)比對(duì)照組(34.3ng/ml)顯著較低,而且病齡長(zhǎng)的患者的維生素D水平也更低。
1986年已經(jīng)有開(kāi)放標(biāo)簽臨床研究發(fā)現(xiàn)維生素D可以改善銀屑病。 [27] 連續(xù)6個(gè)月補(bǔ)充維生素D3的銀屑病患者,76%顯著改善病情。
1988年的臨床研究,[28] 發(fā)現(xiàn)口服維生素D和外用維生素D軟膏對(duì)改善銀屑病都有幫助。 17名銀屑病受試者,14名口服維生素D的受試者,當(dāng)中10名顯著改善,3名使用外用維生素D的受試者同樣顯著改善,而且6周后就見(jiàn)效果。
科英布拉療法(Coimbra Protocol)是使用大劑量維生素D的治療方法。2013年先導(dǎo)性臨床試驗(yàn),[29]對(duì)銀屑病(9名)患者連續(xù)6個(gè)月每天使用35000IU的維生素D,治療后銀屑病受試者的維生素D水平從起始的平均14.9ng/ml提升到106.3ng/ml,結(jié)果全部9名銀屑病受試者病情顯著改善,檢查受試者期間的肝功能,腎功能和血鈣沒(méi)有出現(xiàn)異常,尿液排出鈣期間則在正常范圍內(nèi)有所增加。科英布拉療法較受爭(zhēng)議性,但該研究的確發(fā)現(xiàn)維生素D可以成功改善銀屑病。
2019年泰國(guó)發(fā)病的一項(xiàng)雙盲對(duì)照組臨床研究,[30] 45名輕度銀屑病患者(PASI<10)接受試驗(yàn),干預(yù)組每2周口服一次60000IU的維生素D2,對(duì)照組只有安慰劑。受試者有26.7%缺乏維生素D(<20ng/ml),高于泰國(guó)缺乏維生素D的平均人群(5.7%接近)5倍。3個(gè)月后補(bǔ)充維生素D的干預(yù)組的PASI指數(shù)改善優(yōu)于對(duì)照組,血清維生素D水平也提升了,而且血清維生素D水平跟PASI指數(shù)有反向關(guān)系。
紫外線治療銀屑病有一定效果,當(dāng)中提升維生素D水平可能是其中的重要機(jī)制。臨床研究使用紫外線治療銀屑病,同時(shí)發(fā)現(xiàn)銀屑病患者在病情改善的同時(shí)血清維生素D水平也上升。[31] 但也有臨床研究發(fā)現(xiàn)口服維生素D對(duì)改善銀屑病沒(méi)有顯著幫助。[32] [33]
外用維生素衍生物(vitamin D analogues)藥膏對(duì)緩解銀屑病有一定效果。2017年的系統(tǒng)性回顧,比較了糖皮質(zhì)醇和維生素D兩種外用藥,結(jié)論是兩者的效果相當(dāng)。[34] 但2012年的一項(xiàng)系統(tǒng)性分析,[35] 包括了51個(gè)臨床試驗(yàn),發(fā)現(xiàn)單獨(dú)的維生素D外用藥,治療成功率只有4%-40%,但混合維生素D和糖皮質(zhì)醇的外用藥,治療成功率可以高一倍,達(dá)到27%-53%。 但維生素D外用藥比激素類藥物更為安全,更適合作為長(zhǎng)期使用。[36]
抗氧化物
文獻(xiàn)回顧發(fā)現(xiàn)不同的抗氧化物的組合對(duì)緩解銀屑病可能有幫助。[37] 但臨床研究并沒(méi)有發(fā)現(xiàn)哪一種抗氧化物對(duì)改善銀屑病顯著有效。
2009年的對(duì)照組臨床研究,[38] 銀屑病患者補(bǔ)充輔酶Q10(50mg泛醇)、維生素E(50mg)和硒可以改善患者的氧化應(yīng)激,干預(yù)組的銀屑病病情有輕微改善。
早年有先導(dǎo)性臨床研究發(fā)現(xiàn)B12可以改善銀屑病,[39] 通過(guò)注射B12的34名銀屑病患者,11名康復(fù),10名達(dá)到PASI 75局部康復(fù)。但另一項(xiàng)對(duì)照組臨床研究,卻發(fā)現(xiàn)B12沒(méi)有幫助。[40] 類似的情況在硒中出現(xiàn),沒(méi)有確切臨床證據(jù)證明硒可以改善銀屑病。
2015年的臨床研究,[41] 63名輕度銀屑病患者(PASI<10),干預(yù)組每天口服2g的姜黃素加外用糖皮質(zhì)醇藥膏,對(duì)照組只使用藥膏,12周后姜黃素干預(yù)組顯著改善,而且血清IL-22致炎癥細(xì)胞因子顯著下降。研究的結(jié)論是姜黃素可以作為輔助治療銀屑病。
2018年的對(duì)照組臨床研究,[42]40名中度到重度頭皮銀屑病患者接受試驗(yàn),干預(yù)組每天兩次使用姜黃(turmeric tonic),9周試驗(yàn)過(guò)后干預(yù)組顯著改善頭皮銀屑病病癥。
2015一項(xiàng)臨床試驗(yàn),使用口服姜黃素作為輔助治療,同樣發(fā)現(xiàn)銀屑病患者有顯著的改善。[43]
2019年的文獻(xiàn)回顧,[44] 分析了姜黃素對(duì)治療不同皮膚有關(guān)疾病的文獻(xiàn),結(jié)論是姜黃素效果不錯(cuò),便宜、安全和有效(low-cost, well-tolerated, effective),但需要克服生物利用率較低的難題。2019年的另一項(xiàng)對(duì)姜黃素和皮膚病的文獻(xiàn)回顧的結(jié)論也是一致的。[45]
總結(jié)
減肥和飲食調(diào)整對(duì)改善銀屑病有不錯(cuò)的效果,除此之外,我們從近年的研究也可以得出下面的結(jié)論:
1 生物制劑可以有效緩解銀屑病,特別是針對(duì)IL-17和IL-23作為靶點(diǎn)的第二代生物制劑;
2 多種生物制劑證明是安全和副作用較少的治療手段,有條件的銀屑病患者可以選擇使用;
3 但生物制劑除了治療成本較高外,也容易造成真菌感染和因?yàn)樾∧c真菌過(guò)度生長(zhǎng)導(dǎo)致的腸道炎癥。
4 生物制劑從“中間介入”阻斷炎癥的級(jí)聯(lián)反應(yīng),但沒(méi)有解決氧化應(yīng)激的源頭問(wèn)題,不太確定究竟生物制劑的效果可以維持多久,也不確定消除銀屑病病癥但不處理導(dǎo)致銀屑病的氧化應(yīng)激是否會(huì)出現(xiàn)其他的炎癥有關(guān)疾病;
5 魚(yú)油治療銀屑病的研究證據(jù)雖然并不一致,但魚(yú)油的安全性和改善身體整體健康的特性,值得使用作為緩解銀屑病的營(yíng)養(yǎng)素;
6 維生素D在治療銀屑病的研究證據(jù)同樣不一致,但經(jīng)檢查發(fā)現(xiàn)缺乏維生素D的,補(bǔ)充足夠的維生素D,對(duì)改善健康都是有益的。缺乏維生素D的銀屑病患者,值得嘗試補(bǔ)充維生素D;
7 臨床研究沒(méi)有發(fā)現(xiàn)什么抗氧化物對(duì)改善銀屑病有很明顯的效果,當(dāng)中姜黃素有一定的證據(jù)支持,但由于較低的生物利用率,限制了它的有效應(yīng)用。
免責(zé)聲明:
本文內(nèi)容僅作為科普知識(shí)提供,不能代替醫(yī)生的治療診斷和建議。文章內(nèi)容中涉及醫(yī)學(xué)的部分均來(lái)源于參考文獻(xiàn)。
參考
[1] Ten Bergen, L. L., Petrovic, A., Krogh Aarebrot, A., & Appel, S. (2020). The TNF/IL-23/IL-17 axis-Head-to-head trials comparing different biologics in psoriasis treatment. Scandinavian journal of immunology, 92(4), e12946. https://doi.org/10.1111/sji.1294
[2] Warren, R. B., Barker, J., Finlay, A. Y., Burden, A. D., Kirby, B., Armendariz, Y., Williams, R., Hatchard, C., Khare, S., & Griffiths, C. (2020). Secukinumab for patients failing previous tumour necrosis factor-α inhibitor therapy: results of a randomized open-label study (SIGNATURE). The British journal of dermatology, 183(1), 60–70. https://doi.org/10.1111/bjd.18623
[3] Langley, R. G., Elewski, B. E., Lebwohl, M., Reich, K., Griffiths, C. E., Papp, K., Puig, L., Nakagawa, H., Spelman, L., Sigurgeirsson, B., Rivas, E., Tsai, T. F., Wasel, N., Tyring, S., Salko, T., Hampele, I., Notter, M., Karpov, A., Helou, S., Papavassilis, C., … FIXTURE Study Group (2014). Secukinumab in plaque psoriasis--results of two phase 3 trials. The New England journal of medicine, 371(4), 326–338. https://doi.org/10.1056/NEJMoa1314258
[4] Cai, L., Zhang, J. Z., Yao, X., Gu, J., Liu, Q. Z., Zheng, M., Zhang, S. F., Xu, J. H., Li, C. X., Cheng, H., Guo, Q., Pan, W. L., Li, S. Q., Li, R. Y., Guo, Z. P., Song, Z. Q., Li, S. S., Dong, X. Q., Wang, L., Fu, R., … Patekar, M. (2020). Secukinumab demonstrates high efficacy and a favorable safety profile over 52 weeks in Chinese patients with moderate to severe plaque psoriasis. Chinese medical journal, 133(22), 2665–2673. https://doi.org/10.1097/CM9.0000000000001163
[5] Okubo, Y., Ohtsuki, M., Morita, A., Yamaguchi, M., Shima, T., Tani, Y., Nakagawa, H., & Extension Study Japanese Subgroup (2019). Long-term efficacy and safety of secukinumab in Japanese patients with moderate to severe plaque psoriasis: 3-year results of a double-blind extension study. The Journal of dermatology, 46(3), 186–192. https://doi.org/10.1111/1346-8138.14761
[6] Craig, S., & Warren, R. B. (2020). Ixekizumab for the treatment of psoriasis: up-to-date. Expert opinion on biological therapy, 20(6), 549–557. https://doi.org/10.1080/14712598.2020.1729736
[7] Li, W., Ghamrawi, R., Haidari, W., & Feldman, S. R. (2020). Risankizumab for the Treatment of Moderate to Severe Plaque Psoriasis. The Annals of pharmacotherapy, 54(4), 380–387. https://doi.org/10.1177/1060028019885836
[8] Blauvelt, A., Burge, R., Malatestinic, W., Brnabic, A., Guo, J., Janardhanan, M., & Zhu, B. (2021). Cost per cumulative clinical benefit of biologic therapies for patients with plaque psoriasis: a systematic review. Journal of managed care & specialty pharmacy, 27(1), 84–94. https://doi.org/10.18553/jmcp.2021.27.1.084
[9] Manasson, J., Wallach, D. S., Guggino, G., Stapylton, M., Badri, M. H., Solomon, G., Reddy, S. M., Coras, R., Aksenov, A. A., Jones, D. R., Girija, P. V., Neimann, A. L., Heguy, A., Segal, L. N., Dorrestein, P. C., Bonneau, R., Guma, M., Ciccia, F., Ubeda, C., Clemente, J. C., … Scher, J. U. (2020). Interleukin-17 Inhibition in Spondyloarthritis Is Associated With Subclinical Gut Microbiome Perturbations and a Distinctive Interleukin-25-Driven Intestinal Inflammation. Arthritis & rheumatology (Hoboken, N.J.), 72(4), 645–657. https://doi.org/10.1002/art.41169
[10] Visser, M., Kell, D. B., & Pretorius, E. (2019). Bacterial Dysbiosis and Translocation in Psoriasis Vulgaris. Frontiers in cellular and infection microbiology, 9, 7. https://doi.org/10.3389/fcimb.2019.00007
[11] Hidalgo-Cantabrana, C., Gómez, J., Delgado, S., Requena-López, S., Queiro-Silva, R., Margolles, A., Coto, E., Sánchez, B., & Coto-Segura, P. (2019). Gut microbiota dysbiosis in a cohort of patients with psoriasis. The British journal of dermatology, 181(6), 1287–1295. https://doi.org/10.1111/bjd.17931
[12] Wu, J. J., Nguyen, T. U., Poon, K. Y., & Herrinton, L. J. (2012). The association of psoriasis with autoimmune diseases. Journal of the American Academy of Dermatology, 67(5), 924–930. https://doi.org/10.1016/j.jaad.2012.04.039
[13] Bittiner, S & Tucker, W.F.G. & Cartwright, I & Bleehen, S. (1988). A double-blind, randomised, placebo-controlled trial of fish oil In psoriasis. Lancet. 1. 378-80. 10.1016/S0140-6736(88)91181-6.
[14] Lassus, A & Dahlgren, Atti-La & Halpern, M.J. & Santalahti, J & Happonen, H. (1990). Effects of Dietary Supplementation with Polyunsaturated Ethyl Ester Lipids (Angiosan?) in Patients with Psoriasis and Psoriatic Arthritis. The Journal of international medical research. 18. 68-73. 10.1177/030006059001800109.
[15] Mayser, Peter & Mrowietz, Ulrich & Arenberger, Peter & Bartak, Pavel & Buchvald, Jozef & Christophers, Enno & Jablonska, Stefania & Salmhofer, Werner & Schill, Wolf-Bernhard & Kr?mer, Hans-Joachim & Schlotzer, Ewald & Mayer, Konstantin & Seeger, Werner & Grimminger, Friedrich. (1998). ω-3 Fatty acid-based lipid infusion in patients with chronic plaque psoriasis: Results of a double-blind, randomized, placebo-controlled, multicenter trial. Journal of the American Academy of Dermatology. 38. 539-47. 10.1016/S0190-9622(98)70114-8.
[16] Grimminger, Friedrich & Mayser, P. & Papavassilis, C. & Thomas, M. & Schlotzer, Ewald & Heuer, K.-U & Führer, D. & Hinsch, K.-D & Walmrath, Dieter & Schill, Wolf-Bernhard & Seeger, W.. (1993). A double-blind, randomized, placebo-controlled trial of n-3 fatty acid based lipid infusion in acute, extended guttate psoriasis. Journal of Molecular Medicine. 71. 634-643. 10.1007/BF00184491.
[17] Gupta, Aditya & Ellis, Charles & TELLNER, D.C. & ANDERSON, T.F. & Voorhees, John. (1989). Double‐blind, placebo‐controlled study to evaluate the efficacy of fish oil and low‐dose UVB in the treatment of psoriasis. British Journal of Dermatology. 120. 801 - 807. 10.1111/j.1365-2133.1989.tb01378.x.
[18] Balbás, G & Sánchez-Rega?a, Manuel & Millet, P. (2011). Study on the use of omega-3 fatty acids as a therapeutic supplement in treatment of psoriasis. Clinical, cosmetic and investigational dermatology. 4. 73-7. 10.2147/CCID.S17220.
[19] Danno, Kiichiro & Sugie, Nobuo. (1998). Combination Therapy with Low-Dose Etretinate and Eicosapentaenoic Acid for Psoriasis Vulgaris. The Journal of dermatology. 25. 703-5. 10.1111/j.1346-8138.1998.tb02487.x.
[20] Clark, C., Taghizadeh, M., Nahavandi, M., & Jafarnejad, S. (2019). Efficacy of ω-3 supplementation in patients with psoriasis: a meta-analysis of randomized controlled trials. Clinical rheumatology, 38(4), 977–988. https://doi.org/10.1007/s10067-019-04456-x
[21] Chen, X., Hong, S., Sun, X., Xu, W., Li, H., Ma, T., Zheng, Q., Zhao, H., Zhou, Y., Qiang, Y., Li, B., & Li, X. (2020). Efficacy of fish oil and its components in the management of psoriasis: a systematic review of 18 randomized controlled trials. Nutrition reviews, 78(10), 827–840. https://doi.org/10.1093/nutrit/nuz098
[22] Yang, Shih-Jyun & Chi, Ching-Chi. (2019). Effects of fish oil supplement on psoriasis: a meta-analysis of randomized controlled trials. BMC Complementary and Alternative Medicine. 19. 10.1186/s12906-019-2777-0.
[23] Zulfakar, M. H., Edwards, M., & Heard, C. M. (2007). Is there a role for topically delivered eicosapentaenoic acid in the treatment of psoriasis?. European journal of dermatology : EJD, 17(4), 284–291. https://doi.org/10.1684/ejd.2007.0201
[24] Katsimbri, Pelagia & Korakas, Emmanouil & Kountouri, Aikaterini & Ikonomidis, Ignatios & Tsougos, Elias & Vlachos, Dionysios & Papadavid, Evangelia & Raptis, Athanasios & Lambadiari, Vaia. (2021). The Effect of Antioxidant and Anti-Inflammatory Capacity of Diet on Psoriasis and Psoriatic Arthritis Phenotype: Nutrition as Therapeutic Tool?. Antioxidants. 10. 157. 10.3390/antiox10020157.
[25] Umar, Meenakshi & Seetharama Sastry, Konduru & Al Ali, Fatima & Al-Khulaifi, Moza & Wang, Ena & Chouchane, Aouatef. (2018). Vitamin D and the Pathophysiology of Inflammatory Skin Diseases. Skin Pharmacology and Physiology. 31. 74-86. 10.1159/000485132
[26] Filoni, Angela & Vestita, Michelangelo & Congedo, Maurizio & Giudice, Giuseppe & Tafuri, Silvio & Bonamonte, Domenico. (2018). Association between psoriasis and vitamin D: Duration of disease correlates with decreased vitamin D serum levels. Medicine. 97. e11185. 10.1097/MD.0000000000011185.
[27] Morimoto, S & Yoshikawa, K & Kozuka, T & Kitano, Y & Imanaka, S & Fukuo, K & Koh, Eunkyung & Kumahara, Y. (1986). An open study of vitamin D3 treatment in Psoriasis vulgaris. The British journal of dermatology. 115. 421-9. 10.1111/j.1365-2133.1986.tb06236.x.
[28] Smith, E & Pincus, S & Donovan, L & Holick, Michael. (1988). A novel approach for the evaluation and treatment of psoriasis. Oral or topical use of 1,25-dihydroxyvitamin D3 can be a safe and effective therapy for psoriasis. Journal of the American Academy of Dermatology. 19. 516-28. 10.1016/S0190-9622(88)70207-8.
[29] Finamor, Danilo & Sinigaglia-Coimbra, Rita & Neves, Luiz & Gutierrez, Marcia & Silva, Jeferson & Torres, Lucas & Surano, Fernanda & Neto, Domingos & Novo, Neil & Juliano, Yara & Lopes, Antonio & Coimbra, Cicero. (2013). A pilot study assessing the effect of prolonged administration of high daily doses of vitamin D on the clinical course of vitiligo and psoriasis. Dermato-endocrinology. 5. 222-34. 10.4161/derm.24808.
[30] Disphanurat, Wareeporn & Viarasilpa, Wongsiya & Chakkavittumrong, Panlop & Pongcharoen, Padcha. (2019). The Clinical Effect of Oral Vitamin D2 Supplementation on Psoriasis: A Double-Blind, Randomized, Placebo-Controlled Study. Dermatology Research and Practice. 2019. 1-9. 10.1155/2019/5237642.
[31] Osmancevic, Amra & Landin-Wilhelmsen, Kerstin & Lark?, Olle & Wennberg, Ann-Marie & Krogstad, Anne-Lene. (2009). Vitamin D production in psoriasis patients increases less with narrowband than with broadband ultraviolet B phototherapy. Photodermatology, photoimmunology & photomedicine. 25. 119-23. 10.1111/j.1600-0781.2009.00418.x.
[32] Jarrett, Paul & Camargo, Carlos & Coomarasamy, Christin & Scragg, Robert. (2017). A randomized, double-blind, placebo-controlled trial of the effect of monthly vitamin D supplementation in mild psoriasis. The Journal of dermatological treatment. 29. 1-18. 10.1080/09546634.2017.1373735.
[33] Ingram, Michelle & Jones, Mary & Jarrett, Paul & Scragg, Robert & Mugridge, Owen & Von Hurst, Pamela. (2018). Oral vitamin D 3 supplementation for chronic plaque psoriasis: A randomized, double-blind, placebo-controlled trial. Journal of Dermatological Treatment. 29. 1-34. 10.1080/09546634.2018.1444728.
[34] Venegas-Iribarren, S., & Andino, R. (2017). Topical corticosteroids or vitamin D analogues for plaque psoriasis?. ?Corticoides tópicos o análogos de vitamina D para la psoriasis en placa?. Medwave, 17(Suppl 2), e6981. https://doi.org/10.5867/medwave.2017.6981
[35] Devaux, S., Castela, A., Archier, E., Gallini, A., Joly, P., Misery, L., Aractingi, S., Aubin, F., Bachelez, H., Cribier, B., Jullien, D., Le Ma?tre, M., Richard, M. A., Ortonne, J. P., & Paul, C. (2012). Topical vitamin D analogues alone or in association with topical steroids for psoriasis: a systematic review. Journal of the European Academy of Dermatology and Venereology : JEADV, 26 Suppl 3, 52–60. https://doi.org/10.1111/j.1468-3083.2012.04524.x
[36] Fogh, K., & Kragballe, K. (2004). New vitamin D analogs in psoriasis. Current drug targets. Inflammation and allergy, 3(2), 199–204. https://doi.org/10.2174/1568010043343930
[37] Winiarska-Mieczan, A., Mieczan, T., & Wójcik, G. (2020). importance of Redox Equilibrium in the Pathogenesis of Psoriasis-Impact of Antioxidant-Rich Diet. Nutrients, 12(6), 1841. https://doi.org/10.3390/nu12061841
[38] Kharaeva, Z., Gostova, E., De Luca, C., Raskovic, D., & Korkina, L. (2009). Clinical and biochemical effects of coenzyme Q(10), vitamin E, and selenium supplementation to psoriasis patients. Nutrition (Burbank, Los Angeles County, Calif.), 25(3), 295–302. https://doi.org/10.1016/j.nut.2008.08.015
[39] RUEDEMANN, R. (1954). Treatment of psoriasis with large doses of vitamin B12, 1,100 micrograms per cubic centimeter; preliminary clinical report. A.M.A. archives of dermatology and syphilology. 69. 738-9.
[40] Baker, Harvey & COMAISH, J. (1963). Is Vitamin B12 of Value in Psoriasis?. British medical journal. 2. 1729-30. 10.1136/bmj.2.5321.1729.
[41] Antiga, Emiliano & Bonciolini, Veronica & Volpi, Walter & Bianco, Elisa & Caproni, Marzia. (2015). Oral Curcumin (Meriva) Is Effective as an Adjuvant Treatment and Is Able to Reduce IL-22 Serum Levels in Patients with Psoriasis Vulgaris. BioMed Research International. 2015. 1-7. 10.1155/2015/283634.
[42] Bahraini, Parichehr & Rajabi, Mehdi & Mansouri, P. & Sarafian, Golnaz & Chalangari, Reza & Azizian, Zahra. (2018). Turmeric tonic as a treatment in scalp psoriasis: A randomized placebo-control clinical trial. Journal of Cosmetic Dermatology. 17. 10.1111/jocd.12513.
[43] Carrion, Miguel & Ramírez-Bosca, Ana & Navarro Lopez, Vicente & Martinez-Andres, Asunción & Asín-Llorca, Manuel & Bernd, August & Horga, Jose. (2015). Effects of Curcuma extract and visible light on adults with plaque psoriasis. European journal of dermatology: EJD. 12. 10.1684/ejd.2015.2584.
[44] Vollono, L., Falconi, M., Gaziano, R., Iacovelli, F., Dika, E., Terracciano, C., Bianchi, L., & Campione, E. (2019). Potential of Curcumin in Skin Disorders. Nutrients, 11(9), 2169. https://doi.org/10.3390/nu11092169
[45] Panahi, Y., Fazlolahzadeh, O., Atkin, S. L., Majeed, M., Butler, A. E., Johnston, T. P., & Sahebkar, A. (2019). Evidence of curcumin and curcumin analogue effects in skin diseases: A narrative review. Journal of cellular physiology, 234(2), 1165–1178. https://doi.org/10.1002/jcp.27096
[46] Pleńkowska, J., Gabig-Cimińska, M., & Mozolewski, P. (2020). Oxidative Stress as an important Contributor to the Pathogenesis of Psoriasis. International journal of molecular sciences, 21(17), 6206. https://doi.org/10.3390/ijms21176206
#銀屑病解疑##皮膚健康科普##生物制劑#

張龍東
版權(quán)所有 未經(jīng)許可不得轉(zhuǎn)載
增值電信業(yè)務(wù)經(jīng)營(yíng)許可證備案號(hào):遼ICP備14006349號(hào)
網(wǎng)站介紹 商務(wù)合作 免責(zé)聲明 - html - txt - xml